题目内容
某化学兴趣小组的同学对一瓶久置的熟石灰粉末的组成进行实验探究,请你一起参与他们的探究活动.[提出问题]这瓶熟石灰粉末是否已经变质生成了CaCO3?
[进行猜想]猜想一:熟石灰全部变成了CaCO3. 猜想二:熟石灰部分变成了CaCO3.
猜想三:熟石灰没有变质.
[设计实验]该小组同学对猜想一设计了下列探究方案,请你帮助他们完成下表中相关实验内容.
| 实验步骤 | 实验现象 | 实验结论 |
| ①取样,加适量水,搅拌,过滤 ②取少量滤液于试管中,滴入酚酞试液 ③取少量滤渣于试管中,加入盐酸 |
② ③ |
猜想一成立 |
(2)小明想测定熟石灰样品中Ca(OH)2的质量分数,称取上述1.0g熟石灰样品,加适量水使之充分溶解,搅拌过滤后,在实验室用pH试纸和配制好的10%盐酸溶液进行实验,实验数据记录见下表.
| 加入盐酸溶液的质量/g | 0 | 4 | 7.3 | 12 |
| 样品的pH | 12 | 9 | 7 | 4 |
②请计算熟石灰样品中Ca(OH)2的质量分数.
分析:熟石灰变质是指Ca(OH)2和空气中的二氧化碳反应生成CaCO3.
在[设计实验]中,最后的结论是猜想一成立,即:熟石灰全部变成了CaCO3.可以断定样品中没有Ca(OH)2,则滤液呈中性,酚酞不变色;滤渣全部为CaCO3,加盐酸会全部溶解,并产生二氧化碳.
在[反思与应用]中,若猜想二成立,说明样品中还有部分的Ca(OH)2,则滤液呈碱性,酚酞变红.
(2)、①PH=4,说明溶液显酸性,即盐酸溶液过量,则溶液中所含的溶质有两种,分别是反应生成的CaCl2和剩余的 HCl.
②、要计算样品中Ca(OH)2的质量分数,可以根据当溶液为中性时消耗的盐酸溶液的质量来计算样品中Ca(OH)2的质量.因为溶液呈中性说明盐酸和Ca(OH)2恰好完全反应.
在[设计实验]中,最后的结论是猜想一成立,即:熟石灰全部变成了CaCO3.可以断定样品中没有Ca(OH)2,则滤液呈中性,酚酞不变色;滤渣全部为CaCO3,加盐酸会全部溶解,并产生二氧化碳.
在[反思与应用]中,若猜想二成立,说明样品中还有部分的Ca(OH)2,则滤液呈碱性,酚酞变红.
(2)、①PH=4,说明溶液显酸性,即盐酸溶液过量,则溶液中所含的溶质有两种,分别是反应生成的CaCl2和剩余的 HCl.
②、要计算样品中Ca(OH)2的质量分数,可以根据当溶液为中性时消耗的盐酸溶液的质量来计算样品中Ca(OH)2的质量.因为溶液呈中性说明盐酸和Ca(OH)2恰好完全反应.
解答:解:[设计实验]、猜想一成立,说明样品中没有Ca(OH)2.则滤液呈中性,加入酚酞试液无明显现象.向滤渣中加入稀盐酸就是CaCO3和稀盐酸反应,由于碳酸钙和稀盐酸反应会生成CO2,所以会有气泡产生.
故答案为:②、无明显现象;③、产生大量气泡,滤渣全部溶解.
[反思与应用]、若猜想二成立,说明样品中还有部分Ca(OH)2,则滤液呈碱性,在加入酚酞试液后会使酚酞变红.
故答案为:滤液变红.
(2)、①、当PH=4时,说明溶液呈酸性,从题目中可以看出原因一定是加入的盐酸过量.则反应后生成的溶液中所含的溶质除了生成的CaCl2外,还有剩余盐酸中的溶质HCl.
故答案为:CaCl2、HCl.
(2)、②、由题意可知当加入盐酸的质量为7.3g时,盐酸和Ca(OH)2恰好完全反应.
则参加反应的HCl的质量为7.3g×10%=0.73g
设:样品中Ca(OH)2的质量为x
Ca(OH)2+2HCl=CaCl2+2H2O
74 73
x 0.73g
=
x=0.74g
样品中Ca(OH)2的质量分数为:
×100%=74%
答:样品中Ca(OH)2的质量分数为74%.
故答案为:②、无明显现象;③、产生大量气泡,滤渣全部溶解.
[反思与应用]、若猜想二成立,说明样品中还有部分Ca(OH)2,则滤液呈碱性,在加入酚酞试液后会使酚酞变红.
故答案为:滤液变红.
(2)、①、当PH=4时,说明溶液呈酸性,从题目中可以看出原因一定是加入的盐酸过量.则反应后生成的溶液中所含的溶质除了生成的CaCl2外,还有剩余盐酸中的溶质HCl.
故答案为:CaCl2、HCl.
(2)、②、由题意可知当加入盐酸的质量为7.3g时,盐酸和Ca(OH)2恰好完全反应.
则参加反应的HCl的质量为7.3g×10%=0.73g
设:样品中Ca(OH)2的质量为x
Ca(OH)2+2HCl=CaCl2+2H2O
74 73
x 0.73g
| 74 |
| 73 |
| x |
| 0.73g |
x=0.74g
样品中Ca(OH)2的质量分数为:
| 0.74g |
| 1.0g |
答:样品中Ca(OH)2的质量分数为74%.
点评:这是一道综合性很强的实验题和计算题.实验部分要根据结论推出实验现象.需要注意一些关键的词,如猜想一中的“全部”、猜想二中的“部分”.计算部分关键是要看懂表格所显示的内容--溶液呈中性就表示恰好完全反应.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
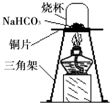 12、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
12、碳酸氢钠(NaHCO3)俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.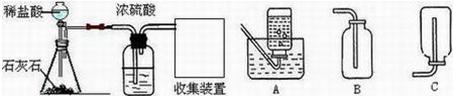
 (2012?烟台)某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹.
(2012?烟台)某化学兴趣小组的同学用如图所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹. 某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.
某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其测定某稀盐酸中溶质的质量分数.