题目内容
【题目】某小组同学用盐酸和氢氧化钙对酸和碱的中和反应进行探究,请你参与。
甲同学向盛有氢氧化钙溶液的烧杯中加入盐酸,无明显现象。结论:两种物质未发生反应。
乙同学向盛有氢氧化钙溶液(滴有几滴酚酞溶液)的试管中慢慢滴加盐酸,溶液由 ① 色变为无色。结论:两种物质发生了反应。反应的化学方程式为 ② 。
大家认为乙的实验证明盐酸与氢氧化钙发生了中和反应。并对甲的实验继续探究。
[提出问题]甲实验后的溶液中有什么溶质?
[作出猜想]猜想一,只有CaCl2;猜想二,有CaCl2和Ca(OH)2;猜想三,有CaCl2和HCl。
[实验探究]为验证猜想,丙同学设计了方案1和方案2,并按方案进行实验。

[实验结论]丙认为猜想三正确。
[实验评价]丙的实验操作和方案中有不足之处,其不足之处是 ③ 。
大家讨论后通过方案3即证明了猜想三正确,其实验中应观察到的现象为 ④ 。
[实验拓展]为节约资源和避免实验废液对环境污染,小组同学将方案1和方案3及甲实验后烧杯中剩余溶液混合(混合时未见明显现象),并对混合液中的盐分离回收。请将相关内容填入下表。

【答案】①红 ②Ca(OH)2+2HCl= CaCl2+2H2O ③方案1中pH试纸的操作不对;方案2中加入AgNO3溶液产生白色沉淀说明溶液中有Cl-,并不能说明溶液中一定有CaCl2 ④先有气体产生,后有白色沉淀产生
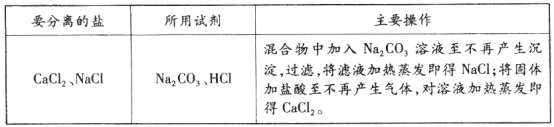
【解析】由于氢氧化钙与盐酸发生的中和反应无明显现象,因此可借助酚酞试液充当该反应的“裁判”,先向氢氧化钙溶液中滴加无色酚酞试液,溶液会变成红色,然后再向变红的氢氧化钙溶液中滴加稀盐酸,当溶液由红色恰好变为无色时,表明氢氧化钙与盐酸恰好完全中和,反应的化学方程式为:Ca(OH)2+2HCl= CaCl2+2H2O;方案1中,将pH试纸直接浸入待测液中的操作不正确,这样会导致pH试纸因浸泡而发生颜色的变化,增大测量误差;方案2中,能够与AgNO3溶液发生化学反应产生白色沉淀的物质可以是HCl,也可以是氯化物(即溶液中有Cl-的物质),因此并不能得出溶液中一定有CaCl2的实验结论;另外,也可用向样品溶液中加碳酸钠溶液的方法,验证甲实验后的溶液中含有CaCl2和HCl(猜想三),若先有气体产生,后有白色沉淀产生[Na2CO3+2HCl=2NaCl+H2O+CO2↑、CaCl2+Na2CO3=CaCO3↓+2NaCl],则可证明猜想三正确;方案1所得溶液与甲实验后烧杯中剩余的溶液的成分一致(含有CaCl2和HCl),方案3将CaCl2和HCl转化NaCl,则将以上溶液混合后,溶液中含有的盐是CaCl2和NaCl,可通过向其中加入适量Na2CO3的方法,将其中的CaCl2先全部转化为碳酸钙沉淀和NaCl,经过滤、蒸发可得到NaCl;然后向滤渣中加入稀盐酸(CaCO3+2HCl=CaCl2+H2O+CO2↑),将CaCO3全部转化为CaCl2,从而实现两种盐的分离。

 暑假作业暑假快乐练西安出版社系列答案
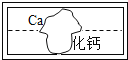
暑假作业暑假快乐练西安出版社系列答案【题目】在学习盐的性质时,某化学兴趣小组的同学将碳酸钠溶液和一瓶标签破损的溶液M(如图)进行反应,有白色沉淀产生,过滤后得到澄清滤液.同学们对该实验进行了一些探究。
探究一 M溶液中的溶质是什么?
(1)【提出猜想】该组同学认为M溶液的溶质有两种可能:①是 ,②是CaCl2.
【收集资料】CaCl2水溶液呈中性。
(2)【设计实验】同学们设计了如下方案并进行实验:
实验操作 | 实验现象 | 实验结论 |
取少量M溶液于试管中,向其中滴加 |
| 猜想①正确,碳酸钠与其反应的化学方程式为 |
探究二 过滤后澄清滤液中会有哪些溶质?
【提出猜想】猜想一:NaOH和Na2CO3;猜想二:_____;猜想三:NaOH
(3)【实验验证】同学们针对“猜想一”进行了如下实验:
实验步骤 | 实验现象 | 实验结论 |
取样于试管中,滴入几滴稀盐酸 | 没有气体产生 | “猜想一”不成立 |
他们的实验结论是否正确? ,理由是 .
(4)【继续探究】设计实验方案确定滤液中溶质的组成.
实验操作 | 实验现象 | 实验结论 |
分别取少量滤液于A、B两支试管中,A中加入CaCI2溶液,B中加入 溶液 | 若A中产生白色沉淀,B中没有沉淀 | “猜想一”成立 |
| “猜想二”成立 | |
| “猜想三”成立 |