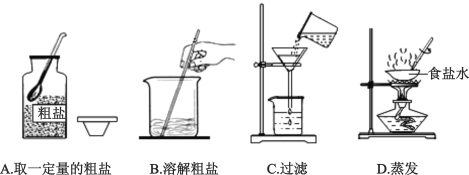
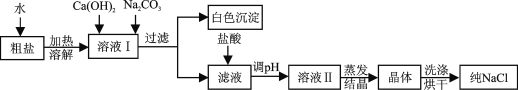
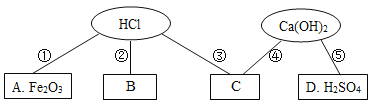
题目内容
【题目】现有一定质量的碳酸钡和碳酸钾的固体混合物,与100g 质量分数14.6%的稀盐酸恰好完全反应,将反应后的溶液蒸干得到34.2g固体,则原混合物中氧元素的质量分数为( )
A.30%B.8.5%C.15%D.17%
【答案】A
【解析】
根据氯元素守恒可知,100g 质量分数14.6%的稀盐酸恰好完全反应,则生成物中氯元素的质量为![]() ,已知反应后的溶液蒸干得到34.2g固体,则金属元素钡和钾的质量之和为34.2g-14.2g=20g;根据化学方程式:BaCO3+2HCl=BaCl2+H2O+CO2↑,.K2CO3+2HCl=2KCl+H2O+CO2↑可知,由于碳酸根和氯离子以1:2的质量比进行反应,即
,已知反应后的溶液蒸干得到34.2g固体,则金属元素钡和钾的质量之和为34.2g-14.2g=20g;根据化学方程式:BaCO3+2HCl=BaCl2+H2O+CO2↑,.K2CO3+2HCl=2KCl+H2O+CO2↑可知,由于碳酸根和氯离子以1:2的质量比进行反应,即![]() ,则可求出碳酸根的质量为12g,因此可求出碳酸钡和碳酸钾的固体混合物质量之和为20g+12g=32g;反应中氧原子与氯离子的个数比为3:2,即元素和氯元素质量之比为
,则可求出碳酸根的质量为12g,因此可求出碳酸钡和碳酸钾的固体混合物质量之和为20g+12g=32g;反应中氧原子与氯离子的个数比为3:2,即元素和氯元素质量之比为![]() ,则氧元素的质量为9.6g,因此原混合物中氧元素的质量分数为
,则氧元素的质量为9.6g,因此原混合物中氧元素的质量分数为![]() ,故选A。
,故选A。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】铜片在空气中久置表面会变绿。某小组同学设计并进行实验,探究铜变绿的条件。
(查阅资料)(1)、铜绿的成分是碱式碳酸铜![]() ,碱式碳酸铜能够与盐酸反应。
,碱式碳酸铜能够与盐酸反应。
(2)、浓硫酸具有吸水性,可以作为一些气体的干燥剂。
(猜想与假设)常温下,铜片变绿可能与![]() 、
、![]() 、水蒸气有关。
、水蒸气有关。
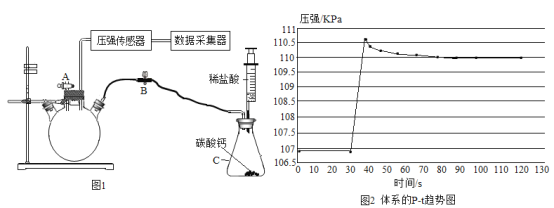
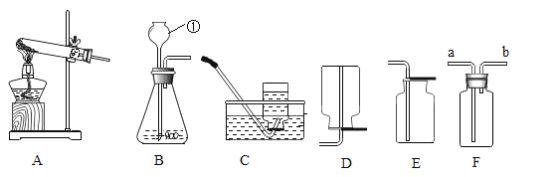
(进行实验)利用下图1装置分别制取并收集气体于试管中,制取气体原理及收集气体等操作见下表。将收集好的气体,用图2所示装置进行4个实验,通过控制与铜片接触的物质,进行实验并持续观察实验现象。
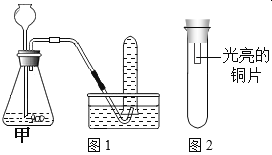
编号 | 主要实验操作 | 实验现象 |
1 | 甲中盛有过氧化氢溶液和二氧化锰,收集一试管气体 | 铜片始终无明显变化 |
2 | 甲中盛有大理石和稀盐酸,收集一试管气体 | 铜片始终无明显变化 |
3 | 甲处先用过氧化氢溶液和二氧化锰反应收集半试管气体,再换盛有大理石和稀盐酸的装置,继续收集至一试管气体 | 一段时间后铜片变绿 |
4 | 甲处先用过氧化氢溶液和二氧化锰反应收集半试管气体,再换盛有大理石和稀盐酸的装置,继续收集至一试管气体,并向气体中加入适量浓硫酸 | 铜片始终无明显变化 |
(解释与结论)
(1)实验1的目的是验证______。
(2)实验2制取气体反应的化学方程式为______。
(3)得出“铜片变绿一定与![]() 有关”的结论,依据的两个实验是______
有关”的结论,依据的两个实验是______![]() 填编号
填编号![]() 。
。
(4)实验4中,试管内的气体主要含有______。
(5)上述实验可推知,铜片变绿的条件是______。
(讨论与交流)
(6)同学们猜想碱式碳酸铜与盐酸反应有二氧化碳生成,证明此猜想所需试剂是______。