题目内容
钠、镁、铝分别跟足量的稀硫酸反应,若生成等质量的H2,则反应的钠、镁、铝的原子数目之比为
| A.1∶2∶3 | B.3∶2∶1 |
| C.6∶3∶2 | D.4∶2∶1 |
C
先计算出产生等质量的氢气需要三种金属的质量比,再用三种金属的质量除以金属的相对原子质量,算出原子个数比.
根据金属的质量× =生成氢气的质量,设钠、镁、铝的质量分别为X、Y、Z则:X×
=生成氢气的质量,设钠、镁、铝的质量分别为X、Y、Z则:X×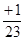 =" Y" ×
=" Y" ×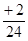 =Z×
=Z×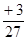 ,可得X:Y:Z=23:12:9,所以钠、镁、铝的原子数目之比为
,可得X:Y:Z=23:12:9,所以钠、镁、铝的原子数目之比为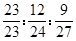 = 6:3:2.
= 6:3:2.
根据金属的质量×
 =生成氢气的质量,设钠、镁、铝的质量分别为X、Y、Z则:X×
=生成氢气的质量,设钠、镁、铝的质量分别为X、Y、Z则:X×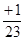 =" Y" ×
=" Y" ×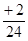 =Z×
=Z×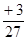 ,可得X:Y:Z=23:12:9,所以钠、镁、铝的原子数目之比为
,可得X:Y:Z=23:12:9,所以钠、镁、铝的原子数目之比为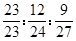 = 6:3:2.
= 6:3:2.
练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
 2CuO + H2O +
2CuO + H2O + ↑,“
↑,“  CaO + CO2 ↑ ,测得反应后固体的质量(m)与反应时间(t)的关系如下表:
CaO + CO2 ↑ ,测得反应后固体的质量(m)与反应时间(t)的关系如下表: