题目内容
【题目】某化学社团的同学发现,不同物质的变化常伴随着相同的实验现象。但从化学的角度去研究,会发现其有本质的区别。
【现象分析】
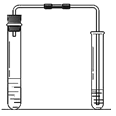
实验一:向盛有一定量氢氧化钠固体的试管里加入一定量的水,迅速用带导管的橡皮塞塞紧试管口,并将导管另一端通入盛有水的试管中,振荡左侧试管(如右图)。
实验二:用氧化钙代替氢氧化钠重复一次上述实验。
上述两个实验的相同现象之一是 ;
上述两个实验中,其中一个实验发生了化学变化,其化学方程式是 ;另一个实验没有发生化学变化。
【本质归纳】相同的实验现象,既可以由物理变化引起,也可以由化学变化引起。
【探究运用】在探究白色粉末的组成时,要研究相同实验现象的本质区别。
实验三:有一包白色粉末可能含有硫酸钡、碳酸钠和氢氧化钙中的一种或几种,取一定量该粉末加入到盛有足量水的烧杯中,搅拌,静置,观察到烧杯中有白色不溶物。
小明同学认为,白色粉末中一定含有硫酸钡;
小意同学认为小明的结论不准确,其理由可用化学方程式表示为 。
针对上述两位同学的观点,小燕同学进一步设计如下实验方案进行探究:
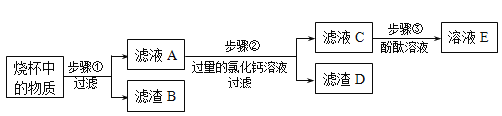
(1)步骤②中发生化学反应的方程式是 ;
(2)步骤③中,加入酚酞溶液后,若溶液E为无色,则原白色粉末的组成是 (填化学式,下同);
步骤③中,加入酚酞溶液后,若溶液E为红色,则滤液A中一定含有的溶质是 ;则原白色粉末的组成为 或 。
(3)小鹏同学只做了一个实验,他取少量滤渣B,加入过量的稀硝酸,观察到 现象,说明原白色粉末中含有碳酸钠、氢氧化钙二种固体。
(4)小鹏同学为进一步测定白色粉末的组成,进行了定量研究。他称取白色固体粉末10g,进行如流程所示实验,测得滤渣B的质量为5g,请你帮小鹏计算一下白色粉末中各成分的质量。(请写出具体计算过程)
【答案】现象分析:左侧试管发热(或右侧试管中有气泡冒出) CaO+H2O=Ca(OH)2
探究运用:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH (1) Na2CO3+CaCl2= CaCO3↓+2NaCl
(2)原白色粉末为:BaSO4和Na2CO3
滤液A中一定有:NaOH、Na2CO3
原白色粉末为:Na2CO3、Ca(OH)2或Na2CO3、Ca(OH)2、BaSO4
(3)滤渣B全部消失(4)Ca(OH)2:4.7g;Na2CO3:5.3g
【解析】
试题分析:氢氧化钠固体溶解放热为物理变化,氧化钙与水反应放热发生化学变化,其方程式为CaO+H2O=Ca(OH)2
可能是碳酸钠和氢氧化钙混合产生沉淀,方程式:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
(1)步骤②中加氯化钙溶液产生沉淀说明溶液中有碳酸钠,碳酸钠与氯化钙作用产生碳酸钙沉淀和氯化钠,方程式为Na2CO3+CaCl2= CaCO3↓+2NaCl
(2)步骤③中,加入酚酞溶液后,若溶液E为无色,说明滤液C呈中性,则固体中一定无Ca(OH)2;原白色粉末的组成是BaSO4和Na2CO3;步骤③中,加入酚酞溶液后,若溶液E为红色,说明滤液C呈碱性,,则固体中一定有Ca(OH)2,那Ca(OH)2 与Na2CO3反应产生NaOH和CaCO3, ,则滤液A中一定含有的溶质是NaOH、Na2CO3, 则原白色粉末的组成为Na2CO3、Ca(OH)2或Na2CO3、Ca(OH)2、BaSO4.
(3)观察到滤渣B全部消失的现象,说明没有BaSO4, 原白色粉末中含有碳酸钠、氢氧化钙二种固体;
解:设白色粉末中Na2CO3的质量为x
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
106 100
X 5g
106/100=x/5g x=5.3g Ca(0H)2的质量为10g-5.3g=4.7g

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案【题目】下表列举了法拉第《蜡烛的故事》中涉及的部分问题及对问题的回答,其中“对问题的回答”属于“设计实验方案”的是
选项 | 问题 | 对问题的回答 |
A] | 吹灭蜡烛时产生的白烟是什么? | 主要成分是石蜡蒸气 |
B | 火焰为什么向上? | 热气流上升,形成对流 |
C | 火焰明亮的原因是什么? | 与火焰中的碳颗粒有关,碳颗粒会影响火焰明亮程度 |
D | 火焰不同部位温度高低如何比较? | 用一根火柴在火焰中心一掠,观察火柴的变化情况 |