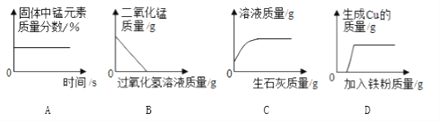
题目内容
【题目】纯碱在生成过程中常混有少量氯化钠,实验中学化学兴趣小组的同学要测定某品牌纯碱样品中碳酸钠的质量分数。他们称取11g样品放入烧杯中,逐滴加入稀盐酸至不再产生气泡为止,共消耗稀盐酸64.7g,烧杯中没有残留物,称得反应后溶液的质量为71.3g。
(1)生成二氧化碳的质量为_____g。
(2)计算样品中碳酸钠的质量分数为_____________。(写出计算过程)
【答案】 4.4 96.4%
【解析】(1)根据质量守恒定律知,生成二氧化碳的质量为11g+64.7g-71.3g=4.4g。
(2)解∶设样品中碳酸钠的质量分数为x
Na2CO3+2HCl==2NaCl + H2O + CO2↑
106 44
11g×x 4.4g
![]() =
=![]() ,x=96.4%。
,x=96.4%。
答∶(1)生成二氧化碳的质量为4.4g;(2)样品中碳酸钠的质量分数为96.4%。
点睛∶灵活应用质量守恒定律,正确书写化学方程式是顺利完成本题的重要保证。

【题目】某气体可能是氢气、一氧化碳、二氧化碳、水蒸气、氯化氢气体中的一种或几种组成,为确定其成分,某兴趣小组设计了如下实验(已知无水硫酸铜遇水变蓝)

气体通过有关装置时观察到的现象如下(假设每步反应均完全进行):
装置编号 | A | B | C | D | E |
试剂 | 硝酸银溶液 | 澄清石灰水 | 氧化铜粉末 | 澄清石灰水 | 无水硫酸铜 |
现象 | 白色沉淀 | 变浑浊 | 变红色 | 无明显变化 | 变蓝色 |
下列说法中错误的是
A. 该气体中一定有氯化氢气体、氢气、二氧化碳
B. 该气体中一定不含一氧化碳
C. 若将装置D、E位置颠倒,可以判断水蒸气是否存在
D. 若将装置A、B位置颠倒,只影响氯化氢气体的检验
【题目】蚊虫叮咬分泌出乙酸刺激皮肤,某兴趣小组对乙酸进行如下的探究:
【查阅资料】:甲酸,又称乙酸,具有酸的通性,甲酸的熔点是8.6℃,受热能分解生成两种物质。
实验探究一:验证甲酸的酸性,完成实验记录。
操作 | 实验现象 | 原理或解释 | |
取甲酸溶于水 | 滴加紫色石蕊 | 溶液变成红色 | 溶液中含有_____填离子符号) |
加适量的锌粒 | 观察到有气泡产生 | 锌粒与甲酸生成了Zn(HCOO)2和一种气体,写出该反应的方程式__________ | |
加氢氧化镁粉末 | 观察到_____ | 甲酸可以与碱反应 |
实验探究二:探究甲酸分解的产物。
【提出猜想】:实验小组对甲酸的分解产物提出了猜想:
猜想1:H2和CO2;猜想二:CO和H2O。
同学们提出以上猜想的依据是:__________________________
【设计实验】根据资料,小组同学从下图装置中选择装置图_______(填“甲”或‘乙’)对甲酸进行加热。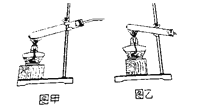
【交流与拓展】资料表明,甲酸的分解产物不同,猜想一与猜想二均成立。据此小林对甲酸的分解产物又提出新猜想-----猜想3:H2O和CO2;猜想四:CO与H2,同学们讨论后认为无需进行实验就知道猜想三和猜想四是错误的,理由是:_____________