题目内容
【题目】同学们对制作糕点常用膨松剂Na2CO3或NaHCO3进行了下列探究。
【查阅资料】

【探究一】NaHCO3和Na2CO3性质差异的探究
(1)现有20℃时溶质质量分数为8%的Na2CO3和NaHCO3溶液
酸碱性:取样于试管中,分别滴加紫色石蕊试液,均显__________色;
酸碱度:NaHCO3溶液___________Na2CO3溶液(填“>”或”“<”)。
(2)稳定性:按下图,实验中可观察乙烧杯中的石灰水变浑浊,甲烧杯不变,则乙烧杯对应的试管中发生反应的化学方程式为:_______________。
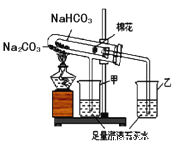
结论:在受热条件下,碳酸钠比碳酸氢钠稳定性___________(填“强”或“弱”)。
(3)利用溶解度鉴别NaHCO3和Na2CO3:分别取Xg两种固体粉末加入20℃,10g水中充分溶解,通过观察溶解现象来区分,X可以是下列的__________。(选填A、B或C)
A.1.5g B.0.96g C.0.5g
【问题讨论】
(4)实验结束时,应先__________(选填A或B)A.熄灭酒精灯 B.把甲、乙烧杯移开
(5)小试管内棉花的作用是_____________
【探究二】测定NaHCO3和Na2CO3混合物10.0g中NaHCO3的质量分数(下图,夹持装置略)
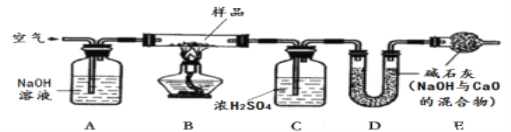
【问题讨论】
(6)实验前先通一段时间的空气的目的是_______________________;
(7)A的作用是_____________________,若没有装置E,NaHCO3的质量分数测定结果会__________________(填“偏大”、“不变”或“偏小”)。
(8)停止加热后,仍继续通入空气一段时间,目的是______________________________。
【含量测定】
(9)测得装置D的质量实验前为120.2g,实验后为122.4g,计算该样品中NaHCO3的质量分数。(要有计算过程)
_______
【知识拓展】
(10)向Na2CO3溶液中通入CO2气体可以生成NaHCO3,该反应的化学反应方程式为:
______________________________________。
【答案】 蓝色 < 2NaHCO3 ![]() Na2CO3 + H2O + CO2↑ 强 A B 防止药品堵塞导气管 排尽装置内的空气(或二氧化碳) 吸收鼓入空气中的二氧化碳 偏大 使反应生成的二氧化碳全部被D吸收 解:设10.0g样品中含碳酸氢钠的质量X
Na2CO3 + H2O + CO2↑ 强 A B 防止药品堵塞导气管 排尽装置内的空气(或二氧化碳) 吸收鼓入空气中的二氧化碳 偏大 使反应生成的二氧化碳全部被D吸收 解:设10.0g样品中含碳酸氢钠的质量X
2NaHCO3 ![]() Na2CO3 + H2O + CO2↑ (1分)
Na2CO3 + H2O + CO2↑ (1分)
168 44
X 124.4g-122.2g
168:X=44:2.2g X=8.4g (1分)
该样品中碳酸氢钠的质量分数为8.4g/10.0g×100%=84% Na2CO3+CO2+H2O==2NaHCO3
【解析】【探究一】
(1)根据溶液pH值分析酸碱性解答;据测定溶液酸碱度的方法以及溶液的酸碱度与酸碱性的关系来分析;
(2)根据碳酸氢钠加热分解为碳酸钠、水和二氧化碳来分析;
(3)根据20℃时碳酸钠和碳酸氢钠的溶解度来分析;
【问题讨论】
(4)根据实验结束时,为防止烧杯中的水到吸入试管,将试管炸裂,应先将甲、乙烧杯移开解答;
(5)根据棉花的作用分析;
【探究二】
(6)根据实验前先通一段时间的空气的目的是排尽装置内的空气(或二氧化碳)解答;
(7)根据空气经过装置A时,其中的二氧化碳与氢氧化钠反应生成碳酸钠和水,若没有此装置,则装置D增重偏大,认为生成的二氧化碳质量偏大解答;
(8)根据停止加热后,仍继续通入空气一段时间,目的是使反应生成的二氧化碳全部被D吸收解答;
【含量测定】
(9)根据反应前后固体减少的质量为生成的二氧化碳的质量,利用反应的化学方程计算解答;
(10)根据反应原理写出反应的化学方程式解答.
解:【探究一】(1)根据溶液pH值可知:Na2CO3溶液和NaHCO3溶液显碱性,滴加紫色石蕊试液,均蓝色;溶液的碱性越强,pH越大,NaHCO3溶液<Na2CO3溶液;
(2)碳酸氢钠加热分解为碳酸钠、水和二氧化碳,试管中发生反应的化学方程式为:2NaHCO3△Na2CO3+H2O+CO2↑;在受热条件下,碳酸钠比碳酸氢钠稳定性强;
(3)20℃时碳酸钠和碳酸氢钠的溶解度分别为21.5g和9.6g,那么在该温度下,10g水中最多溶解2.15g碳酸钠达到饱和,最多溶解0.96g碳酸氢钠达到饱和,因此可分别加入2g固体,充分搅拌后,若完全溶解则为碳酸钠,若不能完全溶解则为碳酸氢钠;故填:A;
【问题讨论】
(4)实验结束时,为防止烧杯中的水到吸入试管,将试管炸裂,应先将甲、乙烧杯移开,故填:B;
(5)棉花的作用:防止药品堵塞导气管;
【探究二】
(6)实验前先通一段时间的空气的目的是排尽装置内的空气(或二氧化碳);
(7)气经过装置A时,其中的二氧化碳与氢氧化钠反应生成碳酸钠和水,若没有此装置,则装置D增重偏大,认为生成的二氧化碳质量偏大,A的作用是吸收鼓入空气中的二氧化碳;造成测定结果偏大;
(8)停止加热后,仍继续通入空气一段时间,目的是使反应生成的二氧化碳全部被D吸收;
【含量测定】
(9)设10.0g样品中含碳酸氢钠的质量x
2NaHCO3=Na2CO3+H2O+CO2↑
168 44
x 124.4g﹣122.2g
![]()
x=8.4g
该样品中碳酸氢钠的质量分数为![]() ×100%=84%
×100%=84%
(10)向Na2CO3溶液中通入CO2气体可以生成NaHCO3,该反应的化学反应方程式为:Na2CO3+CO2+H2O═2NaHCO3。