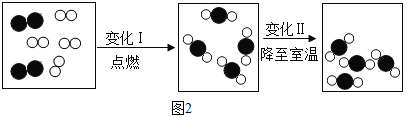
题目内容
【题目】如图![]() 是甲、乙、丙三种固体物质的溶解度曲线图。
是甲、乙、丙三种固体物质的溶解度曲线图。

(1)图1中,20℃时,甲、乙、丙三种物质中,溶解度最大的是_____,50℃时,将40g乙物质放入50g水中,充分搅拌,形成溶液的质量为_____。
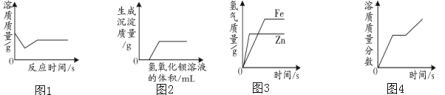
(2)20℃时,进行了如图![]() 所示的实验:
所示的实验:
①上述溶液中属于不饱和溶液的是_____;
②下列操作能使![]() 中溶液溶质的质量分数发生改变的是_____。
中溶液溶质的质量分数发生改变的是_____。
![]() 、加入20g乙 b、加入100g水 c、升温至40℃ d、加入150g40℃时乙的饱和溶液,再恢复至20℃
、加入20g乙 b、加入100g水 c、升温至40℃ d、加入150g40℃时乙的饱和溶液,再恢复至20℃
(3)如表是NaCI、KNO3在不同温度时的溶解度。
温度/℃ |
|
|
|
|
| |
溶解度 |
|
|
|
|
|
|
|
|
|
|
|
| |
①若要比较KNO3与NaCI在水中的溶解能力,需要控制的量是水的质量和_____。
②若将表中数据在坐标系中绘制成NaCI和KNO3的溶解度曲线,两条曲线的交点对应的温度范围是_____(填序号)。
A 0℃20℃ B 20℃40℃ C 40℃60℃ D 60℃80℃
【答案】乙 70g AC bc 温度 B
【解析】
(1)图![]() 中,20℃时,甲、乙、丙三种物质中,溶解度最大的是乙,50℃时,将
中,20℃时,甲、乙、丙三种物质中,溶解度最大的是乙,50℃时,将![]() 乙物质放入
乙物质放入![]() 水中,充分搅拌,形成溶液的质量为
水中,充分搅拌,形成溶液的质量为![]() ,因为该温度下乙的溶解度是
,因为该温度下乙的溶解度是![]() 。
。
(2)①20℃时,乙的溶解度是32g,40℃时溶解度是40g,60℃时,乙的溶解度是45g,故AC是不饱和溶液;
②E溶液是20℃时的饱和溶液,且有晶体不溶解。
a、加入20g乙,E仍为饱和溶液,溶质的质量分数不变;
b、加入100g水后,乙中剩余固体完全溶解,变为同温度下的不饱和溶液,溶质的质量分数减小;
c、升温后,溶解度变大,剩余固体又溶解了10g,溶质质量分数变大;
d、加入浓溶液后,又恢复至原温度,仍为20℃时的饱和溶液,溶质的质量分数不变。故选bc;
(3)若要比较KNO3与NaCl在水中的溶解能力,需要控制的量是水的质量和温度,若将表中数据在坐标系中绘制成NaCl和KNO3的溶解度曲线,两条曲线的交点对应的温度范围是:20℃![]() 40℃。
40℃。

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案