题目内容
【题目】已知 A、B、C、D、E、F、G 是初中化学常见的物质,它们存 在如图所示的关系,图中“→”表示可以向箭头所指的方向一步转化,“— 表示两种物质之间能相互反应(反应条件、部分物质已略去)。已知 A 是 人体胃液中含有的酸,C 可改良酸性土壤,A、B、C、D、E 为五种不 同类别的物质,E、F、G 物质类别相同,请回答下列问题
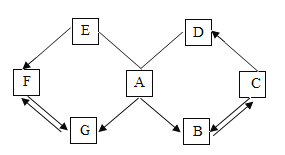
(1)写出 A 的化学式:_____。
(2)写出 F→G 的化学方程式:_____。
【答案】HCl Fe+H2SO4===FeSO4+H2↑或Fe+2HCl===FeCl2+H2↑
【解析】
已知 A 是人体胃液中含有的酸,则A是盐酸,C 可改良酸性土壤,则C是氢氧化钙;A、B、C、D、E 为五种不同类别的物质,那么B、D、E不可能是酸或碱,可能是盐、氧化物或单质。而A、C都能生成B,则B可能是氯化钙或水,但氯化钙不能一步转化为氢氧化钙,所以B为水,水和氧化钙能生成氢氧化钙;C可以生成D,A与D能反应,则D为盐类,所以D为碳酸钙,碳酸钙与盐酸能反应,且氢氧化钙与二氧化碳能生成碳酸钙;根据物质类别E剩余应该为单质, E、F、G 物质类别相同,则G也是单质,盐酸能生成单质G,那么G为氢气;单质F也能生成氢气,则F为较活泼金属单质,E能与盐酸反应,则E也是较活泼金属单质,E生成F,则E的金属活动性要强于F的金属活动性,那么E可以为锌,F可以为铁。
(1)A是人体胃液中含有的盐酸,化学式为HCl。
(2)F→G是铁与稀酸反应生成盐和氢气,化学方程式为:Fe+H2SO4===FeSO4+H2↑或Fe+2HCl===FeCl2+H2↑

【题目】某兴趣小组在制取氧气的实验过程中,有如下实验设计方案,该方案的实验目的是:探究_______对反应速率的影响。
编号 | 温度 | 催化剂 | 氯酸钾、二氧化锰的质量比 | 生成1升氧气所需时间/s |
实验Ⅰ | 400℃ | MnO2 | 1:1 | 153 |
实验Ⅱ | 400℃ | MnO2 | 2:1 | 240 |
小芳在实验时,误把氧化铁当作二氧化锰放入加热,结果发现也能较快产生氧气,于是进行如下探究:
(猜想Ⅰ)除二氧化锰、氧化铜外,氧化铁(Fe2O3)也可以作氯酸钾分解的催化剂。
(设计实验)
按下表进行实验,并测定开始产生气体时的温度(提示:开始产生气体的温度越低,表示反应速度越快)。
实验编号 | 实验药品 | 分解温度(℃) |
① | 氯酸钾 | 580 |
② | 氯酸钾和二氧化锰(质量比1︰1) | 350 |
③ | 氯酸钾和氧化铜(质量比1︰1) | 370 |
④ | 氯酸钾和氧化铁(质量比1︰1) | 390 |
(数据和结论)
(1)由实验_________与实验④对比,证明猜想合理;
(2)实验所用的三种物质中,催化效果最好的是__________。
(反思)
(1)若要证明氧化铁是该反应的催化剂,还需验证它在化学反应前后的______和______是否改变。小林在实验时,联想到了渔民用过氧化钙(CaO2)增加鱼池中的含氧量,提出猜想Ⅱ。
(猜想Ⅱ)过氧化钙与水反应可制取氧气。
实验装置 | 实验主要过程 |
| ①检查装置气密性。 ②加入过氧化钙和水后,有少量细小气泡缓慢放出,在导管口几乎收集不到气体。该装置放置到第二天,集气瓶中只收集到极少量气体,震荡试管后仍有少量细小气泡缓慢放出。 |
实验结论:过氧化钙与水反应________(填“能”或“不能”)用于实验室制取氧气。
(分析与反思)
(1)过氧化钙与水反应虽然没有快速收集到大量氧气,但由此实验现象,小林认为渔民用过氧化钙做增氧剂的主要原因是__________。
(2)小林希望对此实验进行改进,使该反应加快,请你帮他提出合理化建议_________。
(3)同学们对过氧化钙与水反应的生成物猜想如下:①氢氧化钙和氧气②碳酸钙和氧气。你认为猜想_________ (填序号)一定是错误的,理由是_________。
【题目】钠是一种活泼金属,常温下能与氧气、水等物质发生反应。钠与水反应的化学方程式为:2Na+2H2O==2NaOH+H2↑。在实验室,小亮先取定量的硫酸铜溶液于烧杯中,再取一小块钠投入硫酸铜溶液中,充分反应后过滤,得到滤液和蓝色滤渣,并对滤被的成分进行探究。
(提出问题)滤液中溶质的成分是什么?
(查阅资料)Na2SO4溶液呈中性
(猜想与假设)猜想一:Na2SO4
猜想二:Na2SO4和NaOH
猜想三:____________
猜想四:Na2SO4、CuSO4和NaOH
小明认为猜想______不合理,理由是_______(用化学方程式表示)。
(实验与验证)
实验 | 实验操作 | 实验現象 | 实验结论 |
实验一 | 取少量滤液于试管中,仔细观察现象 | 溶液为无色 | 猜想_____不成立 |
实验二 | 向实验一所取滤液中滴入酚酞溶液 | ________ | 猜想二不成立 |
实验三 | 常温下,再取少量滤液,测溶液酸碱度 | pH=7 | 猜想_____成立 |
(拓展延伸)金属活动性顺序表中钠及前面的金属____(填“能”或“不能”)把位于后面的金属从它们盐溶液里置换出来。
【题目】化学学习小组进行“铝和酸溶液反应的探究”的活动。用铝片分别和氢离子浓度相同的稀盐酸、稀硫酸反应,发现铝片和稀盐酸反应现象非常明显,而和稀硫酸却几乎不反应。
(提出问题)是什么原因导致两者的差异?
两种酸中氢离子浓度相同,那么存在的差异就可能跟H+所处的环境不同有关(如阴离子的不同)。
(作出猜想)猜想一:Cl-能促进金属铝与H+的反应。
猜想二:_____。
猜想三:铝表面的致密氧化膜有保护作用,使H+与铝不易接触。
为了验证上述假设,经充分讨论,大家设计了如下实验方案进行验证。
(查阅资料)已知 9.8%H2SO4 溶液和 7.3%HCl 溶液中 H+浓度相同。
(设计实验)
① | 9.8%H2SO4溶液5mL+铝片 | 不加其他试剂(对比) | 无气泡 |
② | 9.8%H2SO4溶液5mL+铝片 | 加入_____溶液 | 有较多气泡 |
③ | 9.8%H2SO4溶液5mL+铝片 | 加入 0.5mL Na2SO4 溶液 | 无气泡 |
④ | 7.3%HCl 溶液 5mL+铝片 | 加入_____溶液 | 有较多气泡 |
⑤ | 7.3%HCl 溶液 5mL+铝片 | 不加其他试剂(对比) | 有较多气泡 |
由实验②③得出猜想_____成立;由④⑤得出猜想_____不成立。为了验证猜想一成立,小明认为只需要在 5mL 9.8%H2SO4 溶液和铝片中加入_____,并与实验①对比即可。
(实验拓展)对于有气体生成的化学反应,我们可以用产生气体的速率来比较反应速率。为准确比较,应该测量收集相同体积气体所需的_____,因此,上述收集氢气应该采用_____法。
为了真实地观察未打磨的铝片与稀盐酸反应的情况,小红用压强传感器测量集气瓶中气体压强的变化,如图所示。
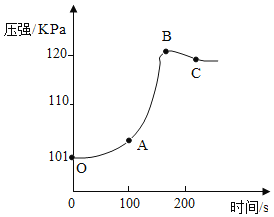
请解释曲线变化的原因:
OA 段_____;AB 段_____;BC 段_____。指出反应结束并恢复到常温时集气瓶内的压强值约为_____kpa。