题目内容
人类的生产生活离不开金属材料。
(1)人们习惯上把金、银、铜、铁、锡五种金属统称为“五金”,在“五金”顺序中把一种金属的位置移到最后 ,则正好符合某种化学规律 。这种金属和该化学规律分别是 、 。
(2)铝、铁、铜是我们生产生活中使用比较广泛的金属。
以上用品中,主要利用金属导热性的是 (填序号)。
(3)铜和铁一样也容易生锈,铜锈的主要成分是碱式碳酸铜〔Cu2(OH)2CO3〕,是铜与空气中的氧气、水和 (填化学式)共同作用的结果。
(4)向铜锈中加入过量稀硫酸,固体逐渐溶解,得到蓝色硫酸铜溶液,从蓝色溶液中回收铜的过程如下:
①操作a的名称 。
②证明N过量选用的试剂是 。
③向蓝色溶液加入过量铁粉,发生反应的化学方程式是 。
(5)回收锈蚀钢重新冶炼是保护金属资源的一条有效途径。写出用一氧化碳在高温条件下还原锈蚀钢铁(主要成分是Fe2O3)的化学方程式 。
某炼铁厂现用1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁92%的生铁的质量是________t(计算结果精确到0.1)。
(1)铁 金属活动性逐渐增强 (2)B (3)CO2
(4)①过滤 ②铁片(或答其他较活拨金属) ③Fe+CuSO4 = FeSO4+Cu
(5)3CO+Fe2O3 2Fe+3CO2 608.7
2Fe+3CO2 608.7
解析试题分析:(1)根据金属活动性顺序可知,把金、银、铜、铁、锡五种金属中的铁的位置移到最后,即可变成金、银、铜、锡、铁,其金属活动性逐渐增强。
(2)物质的性质决定物质的用途,物质的用途反映物质的性质。
A、铜做导线,利用的是铜具有优良的导电性;
B、不锈钢高压锅,利用的是钢的导热性;
C、铝制易拉罐,利用的是铝具有良好的延展性。故选B
(3)由于铜锈的组成元素中含有氢、碳元素,结合空气的成分可知:碱式碳酸铜是铜与空气中的氧气、H2O 及CO2共同作用的结果。
(4))①通过操作a,可从固、液混合物中得到了固体,符合过滤的特征,故操作a的名称是过滤;
②由于铁粉过量,故M中除含有生成的铜以外,还含有剩余的铁粉,要除去铜中的铁,得到纯净的铜,可用稀酸(如稀硫酸)将铁除去,故N应为稀酸,要证明其过量,可用活泼金属与其反应(如铁片),如有气泡产生,则可证明。
③硫酸铜与铁反应,生成了硫酸亚铁和铜,故反应的化学方程式为Fe+CuSO4=FeSO4+Cu。
(5)根据题意,一氧化碳在高温条件下还原氧化铁,生成铁和二氧化碳,故反应的化学方程式为3CO+Fe2O3 2Fe+3CO2
2Fe+3CO2
根据化学变化过程中元素质量不变,赤铁矿石中所含铁元素质量与冶炼出的生铁中含铁元素质量相等,由铁矿石质量可计算生铁质量;设可以冶炼出含铁92%的生铁的质量是x,则有
1000t×80%×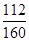 ×100%=x×92%,解得x≈608.7t
×100%=x×92%,解得x≈608.7t
考点:金属活动性顺序及其应用,金属的物理性质,金属锈蚀的条件及其防护,一氧化碳还原氧化铁,含杂质物质的化学反应的有关计算,书写化学方程式
点评:本题主要考查了常见金属的知识,熟练掌握金属活动性顺序及其应用,常见金属的性质,以及金属锈蚀的条件及其防护,是解题的关键;本题最后一问,需要利用质量守恒定律的思想来解答,即赤铁矿石中所含铁元素质量与冶炼出的生铁中含铁元素质量相等。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
 人类的生产生活离不开金属.(1)在地壳里含量居第二位的金属元素是
人类的生产生活离不开金属.(1)在地壳里含量居第二位的金属元素是
 人类的生产生活离不开金属,下列三种金属被发现、使用的先后顺序依次为:铜、铁、铝.
人类的生产生活离不开金属,下列三种金属被发现、使用的先后顺序依次为:铜、铁、铝.