��Ŀ����
����Ŀ��ijУ��ѧ�о���ѧϰС��̽��������ȡ��ʵ��ԭ���뷽����
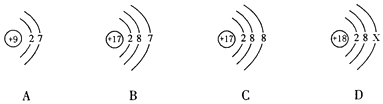
��1����ͬѧ���α��Ļ���֪ʶ����������ͼ��������������������ݣ� 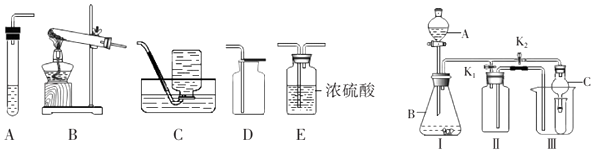
��ȡ���� | ����ҪƷ | װ������˳�� | ��Ӧ��ѧ����ʽ |
����Ķ�����̼ | ����ʯ��ϡ���� |
|
|
��2����ͬѧ��Ƶ�ʵ��װ�ã���ͼ�����ȿ�������ȡ���壬�ֿ�������֤�������ʣ����� K1���ر� K2 ʱ�� ���� I����װ�ÿ�ֱ�ӽ��е�ʵ����������ţ���
�ٴ���ʯ��ϡ���ᷴӦ��ȡ������̼
��п��ϡ���ᷴӦ��ȡ����
��3����ͬѧ��Ϊ�ڲ��ı� I����װ�õ�������λ�õ�ǰ���£���װ�ÿ����ڹ������ƣ�Na2O2��������ˮ ��Ӧ��ȡ��������һ����Ϊ�������ƣ���÷�Ӧ�Ļ�ѧ����ʽΪ�����ĸĽ���ʩ�� ��
��4����ͬѧ�� K2���ر� K1 �� ���� I����װ������֤���ɵĶ�����̼�к���ˮ��������ʱ C ��ʢ�ŵ������� �� ���Թ۲쵽�������� ��
��5����������غͶ������̵Ļ������ȡ O2��Ĺ���������ٶ�����ȫ��Ӧ�������»��մ����� ��ͨ�������IJ�ʵ��������ն������̣���ȷ�������Ⱥ�˳��������дѡ�����a�� ���b�� �ܽ�c������d��ϴ��
���������Ȼ��ؾ������� 50g ��������Ϊ 5%���Ȼ�����Һ����Ҫ�Ȼ��ص�����Ϊ g
�۹��ˡ�����ʱ�����õ���������������ţ���
A�� �ƾ���B�� �ձ�C�� ������D��©��E����Ͳ
��6��С���� 6.5g ���ܺ���ͭ����������þ�е�һ�ֻ��ֽ������ʵ�п�ۣ���������ϡ������ȫ��Ӧʱ������ 0.2g ���������п����һ�����еĽ��������� ��
���𰸡�
��1��AED|CaCO3+2HCl=CaCl2+H2O+CO2��
��2����
��3��2Na2O2+2H2O=4NaOH+O2�������а���߹ܼӳ����ұ߹ܱ��
��4������ͭ����ɫ����ɫ
��5��bcda��2.5��C
��6��ͭ
���������⣺��1��ʵ������ȡCO2 �� ���ڳ����£��ô���ʯ��ʯ��ʯ��ϡ������ȡ�ģ�̼��ƺ����ụ�ཻ���ɷ������Ȼ��ƺ�ˮ�Ͷ�����̼����˲���Ҫ���ȣ�������̼������ˮ���ܶȱȿ������ܶȴ����ֻ���������ſ������ռ���������̼������Ũ���������Դ��ǣ�AED��CaCO3+2HCl=CaCl2+H2O+CO2������2������ K1���ر� K2 ʱ������ I����װ�ÿ�ֱ�ӽ��е�ʵ���Ǣڣ���Ϊ�������ܶȱȿ���С��Ҫ�̹ܽ��룻���Դ��ǣ��ڣ���3���������ƣ�Na2O2��������ˮ��Ӧ��ȡ������ͬʱ�����������ƣ���ƽ���ɣ��Ľ���ʩ�ǣ����а���߹ܼӳ����ұ߹ܱ�̣����Դ��ǣ�2Na2O2+2H2O=4NaOH+O2�������а���߹ܼӳ����ұ߹ܱ�̣���4������ͭ���Լ��������̼�е�ˮ�����������ǣ���ɫ����ɫ�����Դ��ǣ�����ͭ����ɫ����ɫ����5����������غͶ������̵Ļ������ȡO2��Ĺ�����������ն������̵���ȷ�������Ⱥ�˳���ǣ��ܽ⡢���ˡ�ϴ�ӡ���ɣ�50g��5%=2.5g�����ˡ�����ʱ�����õ��������Dz����������Դ��ǣ�bcda��2.5����6��С���� 6.5g ���ܺ���ͭ����������þ�е�һ�ֻ��ֽ������ʵ�п�ۣ���������ϡ������ȫ��Ӧʱ������ 0.2g ���������п����һ�����еĽ���������ͭ����Ϊ��ͬ��������������þ����п�����������ֻ࣬��ͭ��������������˿�����ͭ����������þ�е��κ�һ�ֻ�ϣ����Դ��ǣ�ͭ��
�����㾫����ͨ��������û����ķ��뷽���ͽ������ϵ�ѡ�����ݣ����ջ����ķ��룺1�����˷������������ + ������2���ᾧ�������뼸�ֿ��������ʣ���ɫ������ͨ��ָ�����̡��������ǵĺϽ��ؽ�������ͭ��п��Ǧ�ȣ���ɫ��������������ơ�þ�����ȣ���ɫ������ͨ����ָ����ɫ����������������������Խ����⣮

 ͨ��ѧ��Ĭд����ϵ�д�
ͨ��ѧ��Ĭд����ϵ�д� ���ƽ̸�������ѡ����ĩ���100��ϵ�д�
���ƽ̸�������ѡ����ĩ���100��ϵ�д�����Ŀ����ͼΪ�������ڽ��躣����е�һ��������ͼ2�ǽ��蹤����ʹ�õ�ˮש�� 
��1��ͼ2�е�ˮש�ɶ���ˮ�����ã�ʵ���ҽ��иò���ʱ��ʹ�õ��IJ��������У����������ձ��� ��
��2����ʢ��Ʒ����Һ����ƿ�м��뼸��濾����ľ̿������۲쵽��ƿ��Ʒ����Һ �� ��ô��ľ̿����Ӳˮ�У������Ӳˮ������ˮ�� �� ��ͥ�пɲ���ʲô��������ˮ��Ӳ�� ��
��3����������ָ����������ҩƷ��Ӧ�ÿ��Ʊ�������ƶԱ�ʵ��Ƚϻ���̿��ľ̿��������ǿ����
�Թܡ���������̿��ľ̿����������Ʒ����Һ��������ҩƷ�����������ƣ�
ʵ��������� | �۲쵽������ | ʵ����� |
ʵ���������̿�������Ա�ľ̿��������ǿ |
��ע�⣺ʵ�����������ͼƬ�����������������ԣ��۲쵽������һ��Ҫ��֧��ʵ����ۣ�