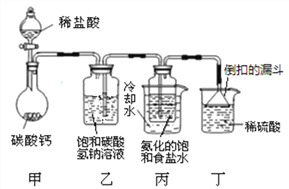
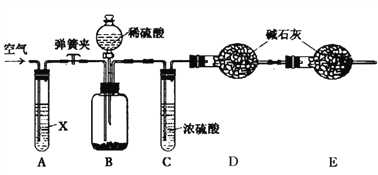
题目内容
【题目】小强买一包纯碱,包装如图,进行实验:准确称取5.5g样品放入烧杯中,向其中滴加盐酸至刚好完全反应(忽略CO2溶于水),共用去稀盐酸25g,得到溶液质量为28.3g(注:杂质溶于水,且与盐酸不反应。)求:

(1)生成CO2的质量为_________;
(2)通过计算判断纯碱样品中碳酸钠的质量分数是否与包装说明相符。________(计算结果精确到0.1%)
【答案】 2.2g 经计算,碳酸钠的质量分数为96.4%,与包装说明不符
【解析】(1)生成二氧化碳的质量为:25g+5.5g28.3g=2.2g;(2)设碳酸钠的质量为x,
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 2.2g
![]() ,解得:x=5.3g
,解得:x=5.3g
碳酸钠的质量分数为: ![]() =96.4%<98%,不符合说明。
=96.4%<98%,不符合说明。
答为:(1) 生成CO2的质量为2.2g;(2)纯碱样品中碳酸钠的质量分数与包装说明不相符。

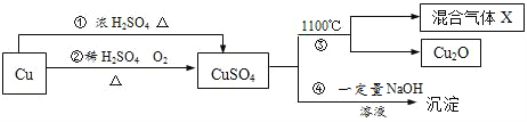
【题目】草酸镍晶体(NiC2O4·2H2O)可用于制镍催化剂。某小组用废镍催化剂(成分为Fe2O3、Ni、Fe、SiO2等)制备草酸镍晶体的部分实验流程如下:
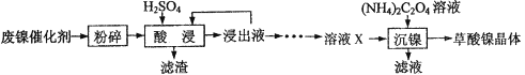
已知:①Ni能和稀H2SO4反应。
②相关金属离子生成氢氧化物沉淀的pH如下表:
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Ni2+ | 6.7 | 9.5 |
③H2O2能将Fe2+氧化为Fe3+
(1)废镍催化剂“粉碎”的目的是______。
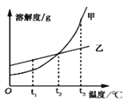
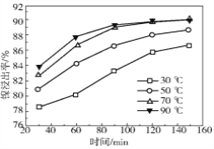
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图,“酸浸”的适宜温度与时间分别为 _______(填字母)。
A.30℃、30min B.90℃、150min C.70℃、120min D.90℃、120min
(3)“酸浸”中发生的复分解反应方程式为________。
(4)“浸出液”得到“溶液x”过程中,加入试剂先后顺序是_____(填字母)。
A.先加H2O2溶液,再加NaOH溶液 B.先加NaOH溶液,再加H2O2溶液
加NaOH溶液调节pH_____(填范围),充分反应后得到滤渣的操作是______,该操作中所用到的玻璃仪器有玻璃棒、烧杯和_________。
(5)将“沉镍”工序:①主要过程为:蒸发浓缩、_____ 、过滤,所得固体用75%乙醇洗涤、110℃下烘干,得草酸镍晶体。
②用75%乙醇洗涤的目的是洗去杂质、___________;
③烘干温度不超过110℃的原因是______。