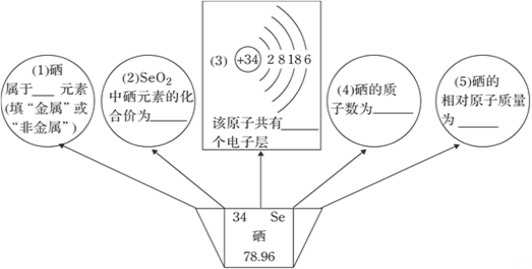
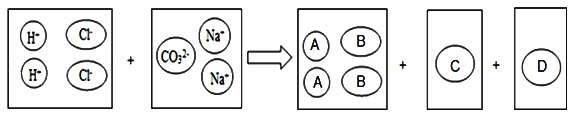
��Ŀ����
����Ŀ��ʵ������һƿ��ǩ�ܵ���ʴ����ͼ��ʾ������ɫ��Һ����ʦ���С��ͬѧ��չ̽����
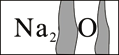
��������⡿��ƿ��ɫ��Һ������ʲô���ʵ���Һ?
����������衿���˽��֪����ƿ��ɫ��Һԭ�Ƿ��ڴ������Һ�Ĺ����
�ɴ˲²⣺��ƿ��ɫ��Һ������̼���ơ�̼�����ơ��Ȼ��ơ������ơ���������ijһ�ֵ���Һ��
�����۷�����Ϊ��ȷ������Һ���������Ƚ����˷�����
��ͬѧ���ݱ�ǩ�ϵ����Ԫ����Ϊһ������������Һ______________��
��ͬѧ�����̼�����ơ������Ƶ���ҺҲ�����ܣ�����������__________________��
�����ʵ�顿Ϊ��ȷ������Һ������ʣ�������ε���һ����Һ���������������ʵ�顣
ʵ����� | ʵ������ |
��ȡ��������ɫ��Һ���Թ��У������μ�BaCl2��Һ�� �ھ��á����ˣ����ɫ�����еμ�__________�� | ������ɫ������ �����������ݣ�������ʧ�� |
��ʵ����ۡ�
��ƿ��ɫ��Һ��������_________�����ɰ�ɫ�����Ļ�ѧ����ʽ��_______________��
��ʵ�鷴˼��
��ͬѧ��Ϊԭ��Ƶ�ʵ�黹�ɼ�ͬ���ﵽ�����Ŀ�ġ���ͬѧ��Ƶ�ʵ�����£���ʵ�������ʵ������������Ӧ�Ŀո��У���
ʵ����� | ʵ������ |
ȡ��������ɫ��Һ���Թ��У�_______________________________________________�� | ______________________ |
���𰸡� �Ȼ��� ̼�����ơ������ƻ�ѧʽ��Na���½�û��2 ϡ���� ̼���� Na2CO3+BaCl2=BaCO3��+2NaCl �μ�����ϡ���� ��������
�������������۷������Ȼ����в�����Ԫ�ء�̼�����ơ������ƵĻ�ѧʽ��Na���½�û��2 �������ʵ�顿�����Ե�̼���������ᷴӦ�� Na2CO3+BaCl2=BaCO3��+2NaCl ��BaCO3+2HCl== BaCl2 +CO2��+H2O ���Ȼ�����һ�ֿ����Ե��Σ������������Ȼ�����Һ��Ӧ���ɵ����ᱵ��������ϡ���ᷴӦ����ʵ����ۡ��ʸ�ƿ��ɫ��Һ��������̼���ƣ����ɰ�ɫ�����Ļ�ѧ����ʽ�ǣ�Na2CO3+BaCl2=BaCO3��+2NaCl��ʵ�鷴˼��̼���ο���ϡ���ᷴӦ�������塣

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�