题目内容
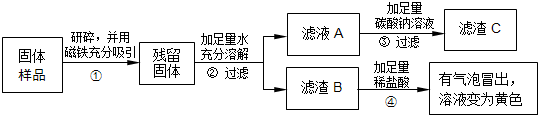
(2013?盐城一模)某兴趣小组的同学在实验室用含有少量氯化钙的氯化钠固体配制一定质量分数的氯化钠溶液.实验步骤如下图所示:

请回答:
(1)生成沉淀C的化学方程式
(2)加入“适量稀HCl”的目的是
(3)操作1、2、3都要用到一种仪器,该仪器在操作3中所起的作用是
(4)配制50g质量分数为3%的氯化钠溶液所需质量分数为6%的氯化钠溶液(密度为1.04g/cm3)的体积为
(5)在用量筒量取所需水的过程中,若俯视读数,而其余操作均正确,这样配得的溶液的溶质质量分数会

请回答:
(1)生成沉淀C的化学方程式
CaCl2+Na2CO3=2NaCl+CaCO3↓
CaCl2+Na2CO3=2NaCl+CaCO3↓
.(2)加入“适量稀HCl”的目的是
除去溶液中过量的碳酸钠
除去溶液中过量的碳酸钠
.(3)操作1、2、3都要用到一种仪器,该仪器在操作3中所起的作用是
使液体受热均匀,防止局部温度过高造成液滴飞溅
使液体受热均匀,防止局部温度过高造成液滴飞溅
.(4)配制50g质量分数为3%的氯化钠溶液所需质量分数为6%的氯化钠溶液(密度为1.04g/cm3)的体积为
24.04
24.04
ml(精确到0.01).(5)在用量筒量取所需水的过程中,若俯视读数,而其余操作均正确,这样配得的溶液的溶质质量分数会
偏高
偏高
(填“偏高”、“偏低”、或“无影响”).分析:(1)根据碳酸钠的作用是除去氯化钙书写反应的方程式;
(2)根据A中反应后的成分分析稀盐酸的用途;
(3)根据操作1、2、3的操作及需要的仪器分析共同的仪器,根据操作3是蒸发操作分析玻璃棒的作用;
(4)根据溶质的质量分数计算式进行分析解答;
(5)根据正确使用量筒读数的方法进行分析,并进而分析溶质的质量分数变化.
(2)根据A中反应后的成分分析稀盐酸的用途;
(3)根据操作1、2、3的操作及需要的仪器分析共同的仪器,根据操作3是蒸发操作分析玻璃棒的作用;
(4)根据溶质的质量分数计算式进行分析解答;
(5)根据正确使用量筒读数的方法进行分析,并进而分析溶质的质量分数变化.
解答:解:(1)加入过量的碳酸钠会和杂质氯化钙反应生成氯化钠和碳酸钙沉淀,反应的方程式是:CaCl2+Na2CO3=2NaCl+CaCO3↓;
(2)因为加入过量的碳酸钠,所以溶液B中存在反应剩余的碳酸钠,对于氯化钠都是杂质,所以加入稀盐酸是为了除去溶液中过量的碳酸钠;
(3)操作1是溶解,操作2是过滤,操作3是蒸发,需要的共同玻璃仪器是玻璃棒;在蒸发中玻璃棒的作用是:搅拌,使液体受热均匀,防止局部温度过高造成液滴飞溅;
(4)配制50g质量分数为3%的氯化钠溶液所需质量分数为6%的氯化钠溶液(密度为密度为1.04g/cm3)的质量是:
=25g,体积是:
≈24.04mL;
(5)在使用量筒读数时,视线要与凹液面的最低处保持水平,俯视导致读数偏大,实际量取水就偏少,所以导致溶液浓度偏高;
故答案为:(1)CaCl2+Na2CO3=2NaCl+CaCO3↓;
(2)除去溶液中过量的碳酸钠;
(3)使液体受热均匀,防止局部温度过高造成液滴飞溅;
(4)24.04;
(5)偏高.
(2)因为加入过量的碳酸钠,所以溶液B中存在反应剩余的碳酸钠,对于氯化钠都是杂质,所以加入稀盐酸是为了除去溶液中过量的碳酸钠;
(3)操作1是溶解,操作2是过滤,操作3是蒸发,需要的共同玻璃仪器是玻璃棒;在蒸发中玻璃棒的作用是:搅拌,使液体受热均匀,防止局部温度过高造成液滴飞溅;
(4)配制50g质量分数为3%的氯化钠溶液所需质量分数为6%的氯化钠溶液(密度为密度为1.04g/cm3)的质量是:
| 50g×3% |
| 6% |
| 25g |
| 1.04g/cm3 |
(5)在使用量筒读数时,视线要与凹液面的最低处保持水平,俯视导致读数偏大,实际量取水就偏少,所以导致溶液浓度偏高;
故答案为:(1)CaCl2+Na2CO3=2NaCl+CaCO3↓;
(2)除去溶液中过量的碳酸钠;
(3)使液体受热均匀,防止局部温度过高造成液滴飞溅;
(4)24.04;
(5)偏高.
点评:本题属于实际操作的除杂题,顺利解答的前提是会分析流程图,在分析流程图时,需要注意其中所加物质的量的多少,如:过量或适量等;并结合溶质的质量分数和所学知识细心分析解答.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
 (2013?盐城一模)红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示.同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究.
(2013?盐城一模)红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示.同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究.