题目内容
(2013?盐城一模)金属是人类生活中的常用的材料.
(1)下列生活用品中,利用金属导热性的是
A.铝制易拉罐 B.铜制火锅 C.铁锅 D.自行车铁架
(2)人体缺铁会造成
A.骨质疏松 B.贫血 C.佝偻病 D.夜盲症
(3)为探究锌、铁、铜三种金属的活动性,以及他们和氢元素的位置关系,小明设计了如下实验,你认为可以省略的实验是
A.将铁粉放入硫酸锌溶液中;B.将铁粉放入稀硫酸中;C.将铁粉放入硫酸铜溶液中;D.将铜片放入稀硫酸中.
(4)该同学查阅资料得知,铜锈的主要成分是碱式碳酸铜【Cu2(OH)2CO3,相对分子质量为222】,他以铜锈为原料设计并完成如图实验(杂质不与稀硫酸反应,且不含铜元素.图中部分物质略去).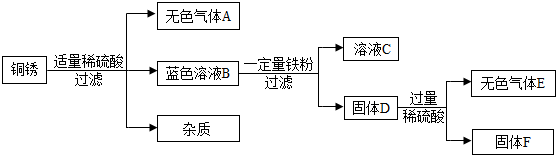
①无色气体A是
②在蓝色溶液B中加入一定量铁粉时,肯定发生反应的化学方程式为
(1)下列生活用品中,利用金属导热性的是
BC
BC
(填字母序号).A.铝制易拉罐 B.铜制火锅 C.铁锅 D.自行车铁架
(2)人体缺铁会造成
B
B
(填字母序号),青少年缺钙会造成C
C
(填字母序号).A.骨质疏松 B.贫血 C.佝偻病 D.夜盲症
(3)为探究锌、铁、铜三种金属的活动性,以及他们和氢元素的位置关系,小明设计了如下实验,你认为可以省略的实验是
C
C
(填字母序号).A.将铁粉放入硫酸锌溶液中;B.将铁粉放入稀硫酸中;C.将铁粉放入硫酸铜溶液中;D.将铜片放入稀硫酸中.
(4)该同学查阅资料得知,铜锈的主要成分是碱式碳酸铜【Cu2(OH)2CO3,相对分子质量为222】,他以铜锈为原料设计并完成如图实验(杂质不与稀硫酸反应,且不含铜元素.图中部分物质略去).

①无色气体A是
二氧化碳
二氧化碳
,溶液C中所含的溶质是硫酸亚铁
硫酸亚铁
,[固体D的成分是铁、铜
铁、铜
.:②在蓝色溶液B中加入一定量铁粉时,肯定发生反应的化学方程式为
Fe+CuSO4=Cu+FeSO4
Fe+CuSO4=Cu+FeSO4
;已知铜锈样品的质量分数是10g,固体F的质量是3.2g,则铜锈中含Cu2(OH)2CO3的质量分数是55.5%
55.5%
(结果精确至0.1%).分析:(1)金属具有良好的导电性、导热性、延展性等;
(2)人体缺乏铁元素时易患贫血症,缺乏钙元素时易患佝偻病或骨质疏松症;
(3)在金属活动性顺序中,排在氢前面的金属,能够和稀盐酸、稀硫酸发生置换反应,生成氢气和相应的盐;排在金属活动性顺序前面的金属,能够把排在后面的金属从它的盐溶液中置换出来;
(4)根据实验现象可以判断物质的名称,通过计算可以确定Cu2(OH)2CO3的质量分数.
(2)人体缺乏铁元素时易患贫血症,缺乏钙元素时易患佝偻病或骨质疏松症;
(3)在金属活动性顺序中,排在氢前面的金属,能够和稀盐酸、稀硫酸发生置换反应,生成氢气和相应的盐;排在金属活动性顺序前面的金属,能够把排在后面的金属从它的盐溶液中置换出来;
(4)根据实验现象可以判断物质的名称,通过计算可以确定Cu2(OH)2CO3的质量分数.
解答:解:(1)铜制火锅、铁锅是利用了铜、铁具有良好的导热性.
故填:BC.
(2)人体缺铁易患贫血症,青少年缺钙易患佝偻病,中老年缺钙易患骨质疏松症.
故填:B;C.
(3)将铁粉放入硫酸锌溶液中,无明显现象,说明锌比铁活泼,将铁粉放入稀硫酸中,有气泡产生,说明铁排在氢的前面,将铜片放入稀硫酸中,无明显现象,说明铜排在氢的后面,由此可知,锌、铁、铜三种金属的活动性为锌>铁>(氢)>铜;
可以省略的实验是将铁粉放入硫酸铜溶液中.
故填:C.
(4)①碱式碳酸铜和稀硫酸反应能生成硫酸铜、水和二氧化碳,无色气体是二氧化碳;
向固体D中加入过量稀硫酸时,产生无色气体,是氢气,是由稀硫酸和铁反应生成的,说明铁粉过量,溶液C中所含的溶质是硫酸亚铁;
固体D中含有生成的铜和过量的铁粉.
故填:二氧化碳;硫酸亚铁;铁、铜.
②蓝色溶液B是硫酸铜溶液,能和铁反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4=Cu+FeSO4.
故填:Fe+CuSO4=Cu+FeSO4.
解:设Cu2(OH)2CO3的质量分数为X,
固体F是铜,即生成的铜的质量是3.2g,
10g×X×
×100%=3.2g,
X=55.5%.
故填:55.5%.
故填:BC.
(2)人体缺铁易患贫血症,青少年缺钙易患佝偻病,中老年缺钙易患骨质疏松症.
故填:B;C.
(3)将铁粉放入硫酸锌溶液中,无明显现象,说明锌比铁活泼,将铁粉放入稀硫酸中,有气泡产生,说明铁排在氢的前面,将铜片放入稀硫酸中,无明显现象,说明铜排在氢的后面,由此可知,锌、铁、铜三种金属的活动性为锌>铁>(氢)>铜;
可以省略的实验是将铁粉放入硫酸铜溶液中.
故填:C.
(4)①碱式碳酸铜和稀硫酸反应能生成硫酸铜、水和二氧化碳,无色气体是二氧化碳;
向固体D中加入过量稀硫酸时,产生无色气体,是氢气,是由稀硫酸和铁反应生成的,说明铁粉过量,溶液C中所含的溶质是硫酸亚铁;
固体D中含有生成的铜和过量的铁粉.
故填:二氧化碳;硫酸亚铁;铁、铜.
②蓝色溶液B是硫酸铜溶液,能和铁反应生成硫酸亚铁和铜,化学方程式为:Fe+CuSO4=Cu+FeSO4.
故填:Fe+CuSO4=Cu+FeSO4.
解:设Cu2(OH)2CO3的质量分数为X,
固体F是铜,即生成的铜的质量是3.2g,
10g×X×
| 128 |
| 222 |
X=55.5%.
故填:55.5%.
点评:化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,有助于提高观察实验、进行实验的能力.

练习册系列答案
相关题目
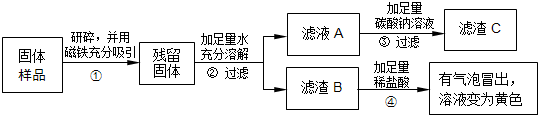
 (2013?盐城一模)红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示.同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究.
(2013?盐城一模)红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示.同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究.