题目内容
【题目】酸碱盐在生活和生产中有广泛的应用。
(1)钠是人体必需的常量元素,它在人体内主要以_________形式存在。
A单质
B化合物
C离子
(2)根据生活经验推测,汗水中产生咸味的物质可能是____________(填化学式)。
(3)如图是浓盐酸试剂瓶上标签的部分内容。请回答:

①现要配制9%的稀盐酸160g,需要这种浓盐酸_______g。
②打开一段时间后,浓盐酸的溶质质量分数小于36%,原因是__________。
(4)为除去粗盐中CaCl2、MgCl2、Na2SO4、可溶性杂质,需进行如下操作:①溶解;②过量的Na2CO3溶液;③过量的NaOH溶液;④过量的BaCl2溶液;⑤过滤;⑥加适量稀盐酸;⑦蒸发、结晶。[提示:Mg(OH)2、BaSO4、BaCO3难溶于水;微溶物不形成沉淀]
Ⅰ.写出此过程的正确操作顺序____________。
Ⅱ.写出此过程中加入过量Na2CO3溶液的目的_____________。
Ⅲ.经过提纯后得到NaCl固体的质量大于原样品中NaCl的质量,试分析其原因_____________。
(5)将一定量的Na2CO3溶液与50g稀盐酸混合,恰好完全反应,反应后测得溶液的总质量减少了4.4 g。求稀盐酸中溶质的质量分数_________。
【答案】C NaCl 40 浓盐酸具有挥发性 ①③④②⑤⑥⑦(或①④②③⑤⑥⑦或①④③②⑤⑥⑦) 除去溶液中的CaCl2及过量的BaCl2 在粗盐提纯的过程中有NaCl生成 14. 6%
【解析】
(1)钠是人体必需的常量元素,人体补充钠元素主要途径是食用氯化钠,氯化钠是由钠离子和氯离子构成的,所以钠在人体内主要以离子形式存在。故选C。
(2)人体长期食用氯化钠来补充钠元素,氯化钠是有咸味的,所以汗水中产生咸味的物质可能是NaCl。
(3)① 解:设需要这种浓盐酸的质量为M。
![]() 解得M= 40g,所以,配制9%的稀盐酸160g,需要这种浓盐酸40g。
解得M= 40g,所以,配制9%的稀盐酸160g,需要这种浓盐酸40g。
② 打开一段时间后,浓盐酸的溶质质量分数小于36%,原因是浓盐酸具有挥发性,挥发了部分氯化氢气体,导致溶液中溶质量变小,溶质质量分数就会变小。
(4)Ⅰ、除去粗盐中CaCl2、MgCl2、Na2SO4、可溶性杂质,实际上是要除去粗盐中钙离子、镁离子和硫酸根离子,且不能引进新的离子。首先把粗盐用水溶解,根据离子不共存原则和题目给出的药品,除去钙离子用碳酸根离子,除去镁离子用氢氧根离子,除去硫酸根离子用钡离子,除去过量的钡离子用碳酸根离子,所以必需先除硫酸根离子再除钙离子,除去镁离子的顺序是在加盐酸前便可。而过量的碳酸根离子和氢氧根离子用盐酸除去,最后把溶液蒸发结晶即可。所以此过程的正确操作顺序为:①③④②⑤⑥⑦ (或①④②③⑤⑥⑦ 或①④③②⑤⑥⑦ )。
Ⅱ、此过程中加入过量Na2CO3溶液的目的除去溶液中的CaCl2及过量的BaCl2。
Ⅲ.、经过提纯后得到NaCl固体的质量大于原样品中NaCl的质量,原因是在除杂过程中加入碳酸钠和氢氧化钠,增加了钠离子,加入氯化钡和盐酸,增加了氯离子,最终增加了NaCl的质量。
(5)解:反应前后溶液减少的质量即为生成二氧化碳气体的质量,则二氧化碳的质量为4.4 g
设生成4.4 g二氧化碳需要HCl的质量为x
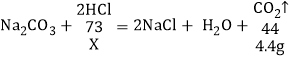
![]()
X=7.3 g
稀盐酸中溶质的质量分数为公![]()
答:稀盐酸中溶质的质量分数为14. 6%。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】如图为实验室常见的气体制备、收集和性质的实验装置,据图回答。
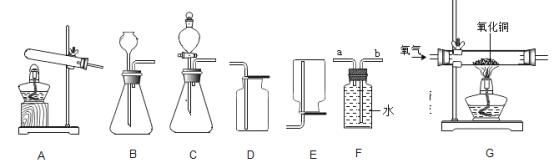
(1)推出C、D装置中标号仪器名称:X_____、Y_____。
(2)O2的制取方法有多种,若用加热氯酸钾的方法制取O2,应选用的发生装置为_____(填装置序号,下同),反应方程式为:_____。
(3)小海同学在装置B中加入15%的过氧化氢溶液和二氧化锰制取氧气。
①若用F装置收集氧气,氧气应从_____(填“a”或“b”)端通入。
②实验中发现不能得到平稳的氧气流。小涛同学提出可以从两个方面加以改进:
一是将制取的装置B换为上图中的装置_____;
二是将过氧化氢溶液加水稀释。如果在80g溶质质量分数为15%的过氧化氢溶液中加入70克水,则所得溶液的溶质质量分数为_____。
(4)实验室用加热氯化铵和氢氧化钙固体混合物制取氨气,生成氨气的化学方程式为_____,为探究氨气的性质,小红用图中G装置进行氨气与氧化铜反应的实验,实验中观察到黑色氧化铜粉末变成红色。
(提出问题)得到的红色粉末是什么?
查阅资科:Cu2O是红色,易与稀硫酸反应:![]()
(猜想假设)红色粉末是①Cu②Cu2O③_____
(设计实验)小明设计如下实验验证红色粉末中是否含有Cu2O
实验步骤 | 实验现象 | 实检站论 |
取红色粉末于试管中,加入足量稀硫酸 | _____ | 红色粉末中含有Cu2O |
(实验反思)小明设计的实验无法证明红色粉末中是否含有Cu,原因是_____。