题目内容
【题目】小芳在实验室用石灰石和稀盐酸制取了二氧化碳,并对实验产生的废液进行溶质成分鉴定:取废液上层清液50克,滴加质量分数为26.5%的碳酸钠溶液,出现气泡,滴加至10克开始出现白色沉淀,继续滴加至沉淀不再产生,过滤,洗涤,干燥,称得沉淀质量为5克,并绘制了图象,如图:

(1)图象中的a点数值
(2)废液中含有的溶质是 (写化学式)
(3)通过计算说明,图象横坐标中b点表示的溶液的质量是多少?
【答案】(1)1.1;(2)HCl、CaCl2;
(3)图象横坐标中b点表示的溶液的质量是30g.
【解析】
试题分析:石灰石和稀盐酸制取二氧化碳产生的废液中一定含有生成的氯化钙,可能含有盐酸;取废液上层清液50克,滴加质量分数为26.5%的碳酸钠溶液,出现气泡,说明废液中含有盐酸;滴加至10克开始出现白色沉淀,说明废液中含有氯化钙;故废液是盐酸和氯化钙溶液的混合物.
图象中的a点数值是产生的二氧化碳的质量,可以根据碳酸钠溶液的质量、溶质的质量分数求出;图象横坐标中的b点表示的碳酸钠溶液的质量,可以根据产生沉淀的质量为5g,由反应的化学方程式计算求出.
解:(1)图象中的a点数值是二氧化碳的质量,设生成的二氧化碳的质量为x
Na2C03+2HCl=2NaCl+H2O+CO2↑
106 44
10g×26.5% x
![]() x=1.1g.
x=1.1g.
(2)取废液上层清液50克,滴加质量分数为26.5%的碳酸钠溶液,出现气泡,说明废液中含有盐酸;滴加至10克开始出现白色沉淀,说明废液中含有氯化钙;故废液是盐酸和氯化钙溶液的混合物,废液中含有的溶质是HCl、CaCl2.
(3)设与氯化钙反应的碳酸钠溶液中溶质质量为y,
CaCl2+Na2C03=2NaCl+CaC03↓
106 100
y 5g
![]() y=5.3g
y=5.3g
所需碳酸钠溶液质量是5.3g÷26.5%=20g
b点表示的溶液的质量为20g+10g=30g.

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】向碳酸氢镁[Mg(HCO3)2]溶液中加入一定量NaOH溶液,出现白色沉淀。某化学兴趣小组同学对该白色沉淀作如下探究:
(查阅资料)I.Mg(OH)2是一种难溶于水的白色固体,MgCO3是一种微溶于水的白色固体。
Ⅱ.Mg(OH)2、MgCO3受热均易分解,分别生成对应的两种氧化物。
Ⅲ.无水硫酸铜是一种白色固体,遇水变蓝。
(作出猜想)猜想一:只有Mg(OH)2;猜想二:只有MgCO3:;猜想三:_____。
(实验1)
步骤 | 实验操作 | 实验现象 | 实验结论 |
步骤1 | 取适量白色固体,加入足量的稀盐酸 | 有气泡产生 | 猜想_____不成立 |
步骤2 | 另取适量白色固体,充分加热,将产生的气体通入盛有无水硫酸铜的U形管 | _____ | 猜想二不成立 |
小张查阅资料得知上述固体是碱式碳酸镁[XMgCO3yMg(OH)23H2O],它不溶于水,受热易分解。
(实验2)
为进一步确定白色固体的组成,小张取一定量白色固体,按下图装置加热至固体质量不再改变,并测定各生成物的质量。
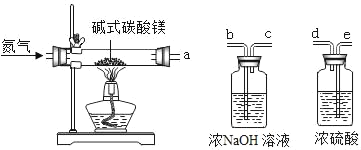
(1)反应结東后若没有继续通一会儿氮气就直接称量洗气瓶的质量,则测得的气体质量将_____(填:“偏大”、“偏小”或“不变”)
(2)为测定各生成物的质量,导管口的连接顺序为a→_____,_____→_____(填字母)。
(3)实验数据:加热完全后剩余固体质量3.20g;浓NaOH溶液增重2.64g;浓硫酸增重1.44g则:x:y=_____。
(拓展延伸)
碱式碳酸镁可作阻燃剂,其可能的原因是_____(选填字母)。
a生成的固体覆盖在燃烧物表面,隔绝氧气
b分解时吸热,使温度难以达到可燃物的着火点
c生成的气体降低了可燃物周围的氧气浓度
【题目】自来水消毒过程中常发生下列转化:
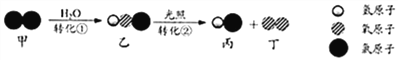
下列说法正确的是 ( )
A. 反应前后分子不可分 B. 转化①是化合反应
C. 转化②中丙和丁的分子个数之比为1︰1 D. 转化①、②中氯元素的化合价都发生变化
【题目】在实验室里加热氯酸钾(KClO3)和二氧化锰的混合物制取氧气,实验测得试管中固体的质量随时间变化的相关数据见下表:请通过计算回答:
加热时间/min | 0 | t1 | t2 | t3 | t4 |
固体质量/g | 28.0 | 25.4 | 23.2 | 18.4 | 18.4 |
请请通过计算回答:
(1)实验过程中共制得氧气_____g;
(2)当完全反应后,二氧化锰的质量为_____g;
(3)原混合物中氯酸钾的质量分数___?(写出计算过程)