题目内容
 (1)如表列出了氯化铵在不同温度下的溶解度.
(1)如表列出了氯化铵在不同温度下的溶解度.| 温度(℃) | 20 | 30 | 40 | 50 |
| 溶解度(g) | 37.2 | 41.4 | 45.8 | 50.4 |
②40℃时向100g水中加入50g氯化铵.充分溶解后所形成的溶液质量为
③若将t℃氯化铵饱和溶液变为不饱和溶液,可采取的方法是
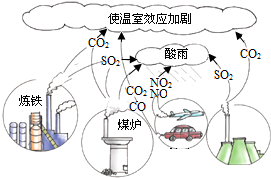
(2)请仔细观察如图,回答有关问题.
①过量排放二氧化碳会导致
②形成酸雨的主要气体有
③请你就如何防止酸雨形成,提一点建议
考点:固体溶解度的影响因素,二氧化碳对环境的影响,饱和溶液和不饱和溶液相互转变的方法,酸雨的产生、危害及防治
专题:化学与环境保护,溶液、浊液与溶解度
分析:(1)①根据表中数据分析解答;
②根据溶解度定义进行简单计算;
③饱和溶液转化为不饱和溶液的方法有加溶剂、降温或升温;
(2)①二氧化碳是一种重要的温室气体;
②二氧化硫、氮氧化物等物质是形成酸雨的重要物质;
③减少化石燃料的燃烧是防止形成酸雨的有效途径.
②根据溶解度定义进行简单计算;
③饱和溶液转化为不饱和溶液的方法有加溶剂、降温或升温;
(2)①二氧化碳是一种重要的温室气体;
②二氧化硫、氮氧化物等物质是形成酸雨的重要物质;
③减少化石燃料的燃烧是防止形成酸雨的有效途径.
解答:解:(1)①由表中数据可以看出:氯化铵溶解度随温度的升高而增大(或20℃时氯化铵的溶解度为37.2g等);故填:氯化铵溶解度随温度的升高而增大(或20℃时氯化铵的溶解度为37.2g等);
②40℃时氯化铵的溶解度为45.8g;即在100g水中最多溶解45.8g氯化铵,所以将50g氯化铵加入100g水中并不能全部溶解,所得溶液质量为45.8g+100g=145.8g;故填:145.8;
③氯化铵溶解度随温度的升高而增大,故将氯化铵饱和溶液变成不饱和溶液可采用的方法有加水或升温;故填:升温(或加水);
(2)①过量排放二氧化碳会导致温室效应.故答案为:温室效应.
②形成酸雨的主要气体有SO2或NO2.故答案为:SO2或NO2.
③减少石化燃料的燃烧可以防止酸雨.故答案为:减少石化燃料的燃烧(合理均可).
②40℃时氯化铵的溶解度为45.8g;即在100g水中最多溶解45.8g氯化铵,所以将50g氯化铵加入100g水中并不能全部溶解,所得溶液质量为45.8g+100g=145.8g;故填:145.8;
③氯化铵溶解度随温度的升高而增大,故将氯化铵饱和溶液变成不饱和溶液可采用的方法有加水或升温;故填:升温(或加水);
(2)①过量排放二氧化碳会导致温室效应.故答案为:温室效应.
②形成酸雨的主要气体有SO2或NO2.故答案为:SO2或NO2.
③减少石化燃料的燃烧可以防止酸雨.故答案为:减少石化燃料的燃烧(合理均可).
点评:饱和溶液与不饱和溶液可以相互转化,饱和溶液变成不饱和溶液最可靠的方法是加水,升温还是降温要根据物质的溶解度与温度的关系确定.

练习册系列答案
相关题目
下列化学反应属于置换反应的是(反应条件省略)( )
| A、CO+CuO═CO2+Cu |
| B、Mg+2HCl═MgCl2+H2↑ |
| C、H2SO4+2NaOH═Na2SO4+H2O |
| D、2KMnO4═K2MnO4+MnO2+O2↑ |

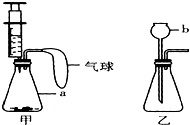 根据如图所示两套装置,请回答:
根据如图所示两套装置,请回答: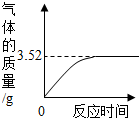 石头纸是一种介于纸张和塑料之间的新型材料.石头纸的主要成分是碳酸钙,为测定某厂生产的石头纸中碳酸钙的质量分数,称取10g石头纸样品,剪碎后加入40g稀硫酸恰好完全反应(假设石头纸中的其他成分不溶于水,也不与稀盐酸反应),测得有关数据如图所示.请计算:
石头纸是一种介于纸张和塑料之间的新型材料.石头纸的主要成分是碳酸钙,为测定某厂生产的石头纸中碳酸钙的质量分数,称取10g石头纸样品,剪碎后加入40g稀硫酸恰好完全反应(假设石头纸中的其他成分不溶于水,也不与稀盐酸反应),测得有关数据如图所示.请计算: