题目内容
【题目】我国多晶硅产量位居世界第一,但副产品存在生态隐患,多晶硅产业以石英资源为基础,石英的主要成分为二氧化硅,它是玻璃工业和陶瓷工业的原料,冶金工业的助熔剂。
(1)二氧化硅的结构与金刚石相似,都是由_________(填“分子”、“原子”、或“离子”)构成,二氧化硅中硅元素的化合价为_______________。
(2)装有氢氧化钠溶液的试剂瓶不能用玻璃塞,原因是在常温下,NaOH与玻璃塞中的SiO2缓慢地发生反应生成Na2SiO3和H2O,而Na2SiO3使瓶口与瓶塞粘合在一起,则该反应的化学方程式为_____________________。
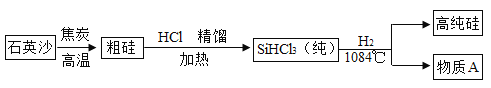
(3)硅是太阳能电池和电脑芯片不可缺少的材料。生产高纯硅的流程示意图如下:
①制备粗硅的反应为:SiO2 +2C![]() Si + 2CO↑,反应的基本类型是_________
Si + 2CO↑,反应的基本类型是_________
②整个制备过程必须达到无水无氧,若在H2还原SiHCl3过程中混入O2,可能引起的后果是_____ 。
③为了达到绿色化学和节约资源的目的,物质A需要循环使用,A的化学式是______
【答案】原子 +4价 2NaOH + SiO2 = Na2SiO3 + H2O 置换反应 硅被氧化得不到高纯硅,且发生爆炸 HCl
【解析】
(1)金刚石是由碳原子构成的,由题意知,二氧化硅的结构与金刚石相似,因此都是由原子构成的。化合物中正负化合价的代数和为0,二氧化硅的化学式为SiO2,氧元素通常显-2价,因此硅元素的化合价为+4价。
(2)由题意知,NaOH与SiO2反应生成Na2SiO3和H2O,常温即可进行,因此化学方程式为2NaOH + SiO2 = Na2SiO3 + H2O。
(3)①上述反应为一种单质与化合物生成另一种单质和另一种化合物的反应,属于置换反应。
②H2还原SiHCl3制取高纯硅时,此时反应条件为高温,若混入氧气,氧气易与硅反应,造成硅的纯度不高,当氧气与氢气的浓度在一定范围之内时,高温条件也易引发爆炸。
③根据质量守恒定律,可推断H2还原SiHCl3制取高纯硅的另一产物为HCl,并且HCl为前面步骤的反应物,故可循环使用。

 名校课堂系列答案
名校课堂系列答案