题目内容
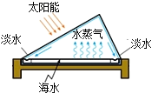
【题目】天津北疆电厂首期工程累计向汉洁市政管网输送140多吨淡化水,开创了国内利用现有市政管网大规模向城市输送淡化海水的先例。海水淡化过程中从海水中提取食盐,并以食盐为原料制得具有广泛用途的烧碱,其制取的主要工艺流程如下:
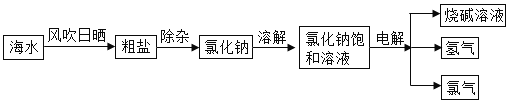
则回答下列问题:
(1)大型海水淡化工厂普遍采用“多级闪急蒸馏法”, 即将海水汽化,水蒸气经冷却而得到高纯度淡水,则说明蒸馏是__________(选填“物理”或“化学”)变化。
(2)淡化工厂的晒盐场上利用风吹日晒可以从海水中提取粗盐,则在风吹日晒过程中的主要作用是________;实验室经过溶解、______、_____可制得精盐,氯化钠在溶解过程中需要搅拌的目的是________ ;
(3)从海水中得到金属镁。下图是从海水中提取镁的一般简单流程:
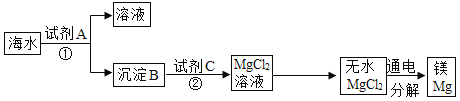
则:①上述过程中,沉淀B与试剂C发生的是中和反应,则沉淀B的化学式为______;由无水MgCl2制取Mg的化学方程式为_______________,该反应的基本类型为_______。
②海水本身就是含有MgCl2的溶液,海水与上述通过步骤①、②得到的MgCl2溶液有何不同:________________。
【答案】物理 蒸发水分 过滤 蒸发 加速溶解 Mg(OH)2 MgCl2![]() Mg+Cl2↑ 分解反应 后者是经过富集和分离后的溶液(或海水中含有NaCl等多种物质,MgCl2的浓度较低)
Mg+Cl2↑ 分解反应 后者是经过富集和分离后的溶液(或海水中含有NaCl等多种物质,MgCl2的浓度较低)
【解析】
(1)蒸馏的过程是水的物态的变化,没有新物质的生成,属于物理变化。
(2)风吹日晒可加速水分蒸发,可提高晒盐效率。制取精盐的过程为溶解、过滤、蒸发,在溶解过程中需要用玻璃棒搅拌,以此加速氯化钠的溶解。
(3)①由沉淀B与试剂C发生的是中和反应,可知其中的物质为酸和碱,以此推断沉淀B为碱,即Mg(OH)2。根据质量守恒定律可知,无水MgCl2制取Mg的另一产物为Cl2,其化学方程式为MgCl2![]() Mg+Cl2↑,该反应为一种物质生成两种物质的反应,故为分解反应。
Mg+Cl2↑,该反应为一种物质生成两种物质的反应,故为分解反应。
②通过步骤①可将Mg2+转化为Mg(OH)2沉淀,步骤②是将沉淀转化为MgCl2,①、②两步可将海水中的MgCl2富集,因此其中MgCl2的浓度更高。

 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案