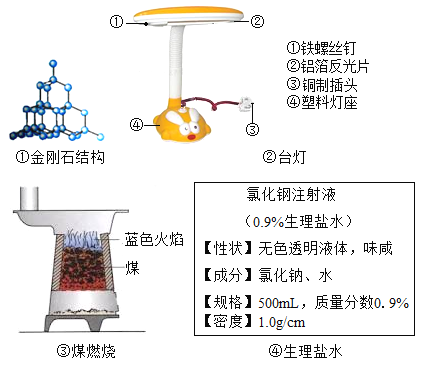
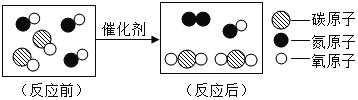
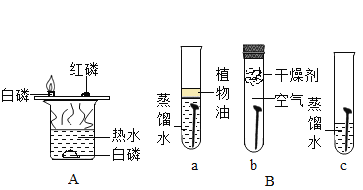
题目内容
【题目】下列实验能达成实验目的的是
A | B | C | D | |
目的 | 检验碳酸盐 | 配制质量分数 10%的NaCl 溶液 | 验证质量守恒定律 | 验证与氧气接触是燃烧的条件之一 |
稀盐酸 | ||||
实验 |
|
|
|
|
A.AB.BC.CD.D
【答案】B
【解析】
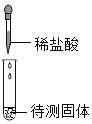
A、实验过程中,即使产生气泡,也不能说明固体是碳酸盐,这是因为比较活泼的金属,例如铁、锌等能和稀盐酸反应生成氢气,该选项不能达到实验目的。
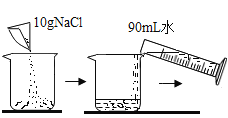
B、配制质量分数10%的NaCl溶液时,把10g氯化钠溶解在90mL水中恰好形成10%的氯化钠溶液,该选项能够达到实验目的。
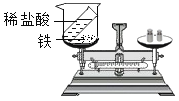
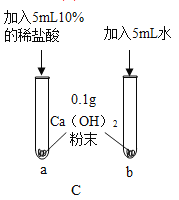
C、铁和稀盐酸反应生成氯化亚铁和氢气,氢气逸出装置,不能用来验证质量守恒定律,选项不能达到实验目的。
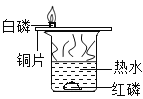
D、实验过程中,即使红磷和氧气接触,也不能燃烧,这是因为热水的温度不能达到红磷的着火点,变量不唯一,该选项不能达到实验目的。
故选:B。

练习册系列答案
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目