题目内容
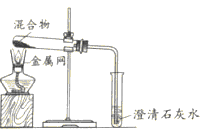
【题目】下图是课堂中模拟炼铁的实验装置(红色粉末为氧化铁)。
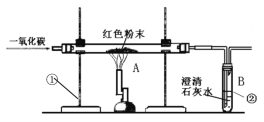
(1)实验过程中,先要进行的是________。(填“加热”或“通一氧化碳”)
(2)A中反应的化学方程式是__________________________________, B中观察到的现象是_______________________________。
(3)该装置的不足之处是__________________________________________。
【答案】通一氧化碳 3CO+Fe2O3![]() 2Fe+3CO2 澄清石灰水变浑浊 未进行尾气处理
2Fe+3CO2 澄清石灰水变浑浊 未进行尾气处理
【解析】
(1)为防止CO与空气混合加热时引起爆炸,进行加热前要先通入CO排出装置内空气;
(2)装置A中通入的CO在高温下还原氧化铁,生成铁和二氧化碳,反应的化学方程式:3CO+Fe2O3![]() 2Fe+3CO2;
2Fe+3CO2;
(3)装置B中澄清石灰水遇二氧化碳变浑浊;
(4)尾气中含有毒气体CO没经处理直接排放到空气中,这是此实验中的不足,应加以改进。

【题目】人教版新课标化学九年级上册教材中“分解过氧化氢制氧气的反应中二氧化锰的催化作用”,以及“寻找新的催化剂”研究性实验,引起了化学探究小组的兴趣。
(提出问题)氧化铁能否作过氧化氢溶液分解的催化剂?如果能,其效果如何?
实验步骤 | 实验现象 |
Ⅰ.分别量取 | A试管中产生气泡,带火星的木条复燃,B试管中无明显现象 |
Ⅱ.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把带火星的木条伸入试管,如此反复多次实验,观察现象 | 试管中均产生所泡,带火星的木条均复燃 |
Ⅲ.将实验Ⅱ中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为 | |
Ⅳ.分别量取 |
(实验结论)
(1)A中产生的气体是______。
(2)实验Ⅱ、Ⅲ证明:氧化铁的______和______在反应前后均没有发生变化,可以作过氧化氢分解的催化剂。
(3)写出氧化铁催化过氧化氢分解的文字表达式:________。
(实验评价)
(4)设计实验Ⅳ的目的是_________。
(5)若实验Ⅳ观察到D试管中产生气泡的速率更快,由此可以得到的结论是____________。
(6)兴趣小组同学又进一步探究二氧化锰的质量对催化效果的影响。图Ⅰ是利用压强传感器研究“二氧化锰质量对过氧化氢分解产生氧气速率的影响”的实验装置。实验测得相关数据整理如图Ⅱ所示。
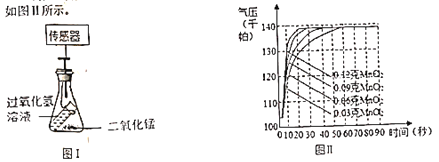
根据实验数据可以得出的结论是_____________。
(实验拓展)
(7)查阅资料得知:![]() 、
、![]() 、猪肝、马铃薯等也可以作过氧化氢溶液分解的催化剂。下列有关催化剂的说法中正确的是______。
、猪肝、马铃薯等也可以作过氧化氢溶液分解的催化剂。下列有关催化剂的说法中正确的是______。
A.![]() 只能作氧化氢溶液分解的催化剂
只能作氧化氢溶液分解的催化剂
B.同一个化学反应可以有多种催化剂
C.催化剂只能加快化学反应的速率
D.用作催化剂的物质不可能是其他反应的反应物或生成物
(8)你还能想到什么因素能影响过氧化氢分解的速率?请举一例说明。因素__________;实验方法:__________。
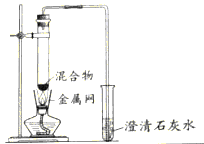
【题目】为探究碳还原氧化铜的最佳实验条件,用木炭粉和氧化铜的干燥混合物1~2.5g进行系列实验。
(查阅资料)①氧化铜(CuO)为黑色固体。②碳还原氧化铜得到的铜中可能含有少量的氧化亚铜;氧化亚铜为红色固体,
(进行实验)
实验1:取质量比1:11的木炭粉和氧化铜混合物1.3g,进行实验。
序号 | 1—1 | 1—2 |
装置 |
|
|
反应后物质的颜色、状态 | 黑色粉末中混有少量红色固体 | 红色固体有金属光泽,混有极少量黑色物质 |
实验2:取一定量的混合物,用1—2装置进行实验。
序号 | 木炭粉与氧化铜的质量比 | 反应后物质的颜色、状态 | |
2—1 | 1:9 | 红色固体有金属光泽 | 混有少量黑色物质 |
2—2 | 1:10 | 混有很少量黑色物质 | |
2—3 | 1:11 | 混有极少量黑色物质 | |
2—4 | 1:12 | 无黑色物质 | |
2—5 | 1:13 | 混有较多黑色物质 | |
(解释与结论)
(1)配平化学方程式:□C+□CuO高温 □Cu+ □CO2↑______,这个反应中CuO是______剂。
(2)实验1—2中,证明此产生了CO2的现象是__________,写出化学方程式______________
(3)实验1的目的是___________。
(4)实验2的结论是:木炭与氧化铜反应的最佳质量比为_______。