题目内容
为了测定某黄铜(铜锌合金)样品的组成,某化学兴趣小组的同学进行了以下实验:取四份相同质量的样品分别放入等质量的烧杯中,然后分别加入稀硫酸,充分反应后用天平称量,记录实验数据如下:| 试验次序 | 第1次 | 第2次 | 第3次 | 第4次 |
| 所取样品的质量 /g | 50.0 | 50.0 | 50.0 | 50.0 |
| 加入稀硫酸的质量/g | 20.0 | 40.0 | 60.0 | 80.0 |
| 生成气体的质量/g | 0.2 | 0.4 | 0.5 | 0.5 |
(1)经分析,在第1次实验结束后,反应物______完全反应完了.
(2)50.0g样品与足量稀硫酸反应最多能生成气体______g
(3)计算样品中锌的质量分数(写出具体计算过程).
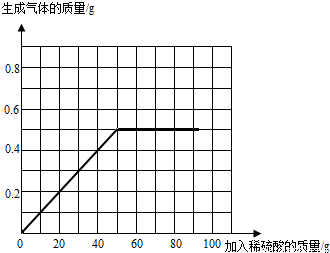
(4)请在图中画出加入稀硫酸的质量与生成气体的质量的变化关系.
【答案】分析:本题是有关化学方程式的计算题,本题属于表格型计算题.此类题目形式多样,主要有两大类:一是根据质量守恒定律,遇到差值求气体;二是减少的质量正好是参加反应的固体质量.本题属于第二种类型,分析题意可知:第一、二次硫酸完全反应,第三、四次硫酸有剩余,锌全部反应.只要认真分析表格的数据,上下联系,问题就会迎刃而解.
解答:解:(1)有题目给出的信息可知:第一、二次所取样品的质量相等的情况下,酸的质量增加生成氢气的质量也增加,说明在第一次中酸完全反应,样品中金属锌有剩余;故答案为:硫酸
(2)有题目给出的信息可知20g稀硫酸完全反应能生成0.2g氢气,所以若60g稀硫酸完全反应可生成0.6g氢气,而第三次中50.0g样品与60g稀硫酸充分反应只生成了0.5g氢气,说明样品完全反应酸有剩余,故50.0g样品与足量稀硫酸反应最多能生成氢气0.5g;故答案为:0.5
(3)计算样品中锌的质量分数必须找一个样品完全反应生成的氢气的质量进行计算;故可根据第三次或第四次氢气的质量进行计算;
设50g样品中锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.5g
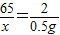
x=16.25g
样品中锌的质量分数为: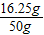 ×100%=32.5%
×100%=32.5%
答:样品中锌的质量分数为32.5%
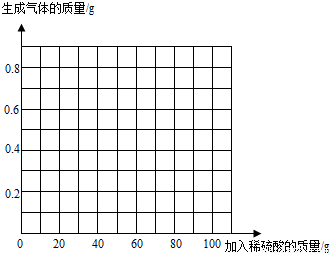
(4)加入稀硫酸的质量与生成气体的质量的变化关系图为:
点评:本考点是有关化学方程式的计算题,属于表格型计算题.近几年的中考计算题,题型多样,主要有表格题、图象题、标签题、图象和表格相联系的综合题以及与文字叙述题等,从不同的方面考查了学生的识图能力、分析能力和计算能力.同学们要认真把握.
解答:解:(1)有题目给出的信息可知:第一、二次所取样品的质量相等的情况下,酸的质量增加生成氢气的质量也增加,说明在第一次中酸完全反应,样品中金属锌有剩余;故答案为:硫酸
(2)有题目给出的信息可知20g稀硫酸完全反应能生成0.2g氢气,所以若60g稀硫酸完全反应可生成0.6g氢气,而第三次中50.0g样品与60g稀硫酸充分反应只生成了0.5g氢气,说明样品完全反应酸有剩余,故50.0g样品与足量稀硫酸反应最多能生成氢气0.5g;故答案为:0.5
(3)计算样品中锌的质量分数必须找一个样品完全反应生成的氢气的质量进行计算;故可根据第三次或第四次氢气的质量进行计算;
设50g样品中锌的质量为x
Zn+H2SO4═ZnSO4+H2↑
65 2
x 0.5g
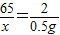
x=16.25g
样品中锌的质量分数为:
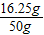 ×100%=32.5%
×100%=32.5%答:样品中锌的质量分数为32.5%
(4)加入稀硫酸的质量与生成气体的质量的变化关系图为:

点评:本考点是有关化学方程式的计算题,属于表格型计算题.近几年的中考计算题,题型多样,主要有表格题、图象题、标签题、图象和表格相联系的综合题以及与文字叙述题等,从不同的方面考查了学生的识图能力、分析能力和计算能力.同学们要认真把握.

练习册系列答案
相关题目
为了测定某黄铜(铜锌合金)中锌的质量分数,某课外兴趣小组利用该合金与实验室中的一瓶稀硫酸反应,进行了若干次实验.现将其中的三次实验数据摘录如下:
请回答下列问题:
(1)第 次实验,黄铜中的锌与稀硫酸恰好完全反应.
(2)计算黄铜中锌的质量分数(写出计算过程).
| 实验次数 | 1 | 2 | 3 |
| 稀硫酸的质量(g) | 100 | 100 | 100 |
| 加入黄铜(铜锌合金)的质量(g) | 6.5 | 13 | 19.5 |
| 生氢气的质量(g) | 0.1 | 0.2 | 0.2 |
(1)第
(2)计算黄铜中锌的质量分数(写出计算过程).
 (2013?苏州模拟)为了测定某黄铜(铜锌合金)样品的组成,某化学兴趣小组的同学进行了以下实验:取四份相同质量的样品分别放入等质量的烧杯中,然后分别加入稀硫酸,充分反映后用天平称量,几率试验数据如下:
(2013?苏州模拟)为了测定某黄铜(铜锌合金)样品的组成,某化学兴趣小组的同学进行了以下实验:取四份相同质量的样品分别放入等质量的烧杯中,然后分别加入稀硫酸,充分反映后用天平称量,几率试验数据如下: