题目内容
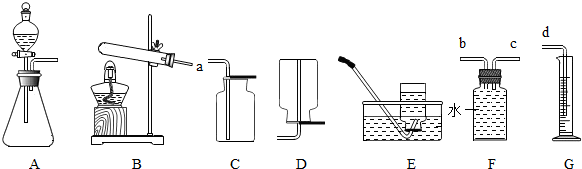
根据下列装置图回答问题(装置图用序号填空).
(1)实验室用高锰酸钾制O2时,应选用
(2)实验室制取H2时,应选用
(3)某化学学习小组在实验室取了3g MnO2加入到试管中,向长颈漏斗中加入50g过氧化氢溶液,待过氧化氢溶液全部滴加完,并经充分反应后,锥形瓶中剩余物质51.4g,请计算产生氧气的质量是多少?所用过氧化氢溶液溶质的质量分数为多少?(写计算过程)

(1)实验室用高锰酸钾制O2时,应选用
D
D
做气体发生装置,反应的化学方程式为2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
.已知MnO2固体和浓盐酸混合共热可制得氯气(Cl2),则应选用
| ||
A
A
做气体发生装置.(2)实验室制取H2时,应选用
B
B
做气体发生装置,反应的化学方程式为Zn+H2SO4═ZnSO4+H2↑
Zn+H2SO4═ZnSO4+H2↑
.有一名同学欲用F装置收集H2,则H2应从导管口b
b
通入.(3)某化学学习小组在实验室取了3g MnO2加入到试管中,向长颈漏斗中加入50g过氧化氢溶液,待过氧化氢溶液全部滴加完,并经充分反应后,锥形瓶中剩余物质51.4g,请计算产生氧气的质量是多少?所用过氧化氢溶液溶质的质量分数为多少?(写计算过程)
分析:(1)根据实验室用高锰酸钾制O2时是固体加热制取气体的装置以及MnO2固体和浓盐酸混合共热可制得氯气(Cl2)是固体和液体混合需要加热的装置进行解答;
(2)根据实验室取H2时是用稀硫酸和锌粒反应,是固体和液体混合不需要加热的装置以及氢气的密度小于空气的密度进行解答;
(3)先根据质量守恒定律计算出生成氧气的质量,然后根据化学方程式求出溶液中过氧化氢的质量,利用溶质质量分数的公式计算过氧化氢溶液的质量分数.
(2)根据实验室取H2时是用稀硫酸和锌粒反应,是固体和液体混合不需要加热的装置以及氢气的密度小于空气的密度进行解答;
(3)先根据质量守恒定律计算出生成氧气的质量,然后根据化学方程式求出溶液中过氧化氢的质量,利用溶质质量分数的公式计算过氧化氢溶液的质量分数.
解答:解:(1)实验室用高锰酸钾制O2时是固体加热制取气体的装置,所以选择D做气体发生装置,反应的化学方程式为2KMnO4
K2MnO4+MnO2+O2↑;MnO2固体和浓盐酸混合共热可制得氯气(Cl2)是固体和液体混合需要加热的装置,所以选择A做气体发生装置;
(2)实验室取H2时是用稀硫酸和锌粒反应,是固体和液体混合不需要加热的装置,所以选择B做气体发生装置,反应的化学方程式为Zn+H2SO4═ZnSO4+H2↑;氢气的密度小于空气的密度,用F装置收集H2,则H2应从导管口b通入;
(3)根据质量守恒定律,产生氧气的质量为:3g+50g-51.4g=1.6g
设过氧化氢溶液中溶质过氧化氢的质量为x
2H2O2
2H2O+O2↑
68 32
x 1.6g
=
x=3.4g
所用过氧化氢溶液的溶质质量分数=
×100%=6.8%
答:产生氧气的质量为1.6g,所用过氧化氢溶液的溶质质量分数是6.8%.
故答案为:(1)D;2KMnO4
K2MnO4+MnO2+O2↑;A;(2)B;Zn+H2SO4═ZnSO4+H2↑;b;(3)1.6g;6.8%.
| ||
(2)实验室取H2时是用稀硫酸和锌粒反应,是固体和液体混合不需要加热的装置,所以选择B做气体发生装置,反应的化学方程式为Zn+H2SO4═ZnSO4+H2↑;氢气的密度小于空气的密度,用F装置收集H2,则H2应从导管口b通入;
(3)根据质量守恒定律,产生氧气的质量为:3g+50g-51.4g=1.6g
设过氧化氢溶液中溶质过氧化氢的质量为x
2H2O2
| ||
68 32
x 1.6g
| 68 |
| x |
| 32 |
| 1.6g |
x=3.4g
所用过氧化氢溶液的溶质质量分数=
| 3.4g |
| 50g |
答:产生氧气的质量为1.6g,所用过氧化氢溶液的溶质质量分数是6.8%.
故答案为:(1)D;2KMnO4
| ||
点评:本题主要考查学生利用质量守恒定律、化学方程式和溶质质量分数公式进行计算的能力.增加了学生分析问题的思维跨度,强调了学生整合知识的能力.

练习册系列答案
相关题目