题目内容
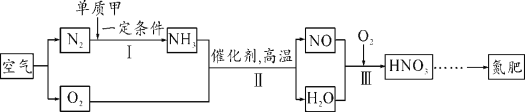
【题目】下图为实验室中常用装置。
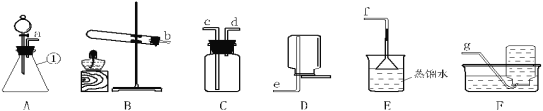
请回答下列问题:
(1)仪器①的名称是____________
(2)实验室用高锰酸钾制取并收集较纯净的氧气所选用的装置是_________(填装置字母),该反应的化学方程式为_________________。
(3)实验室制取氧气,发生装置选取A的优点_____,
(4)通常状况下,氨气是一种无色、有强烈刺激性气味的污染性气体,极易溶解于水形成氨水,相同条件下密度比空气小。常温下实验室可以用浓氨水与生石灰制取氨气。请从上图中选出合适的仪器连接成一套制备并收集氨气的装置,则装置的接口连接顺序是a→dc →f,上述实验中,E装置的作用是______。
【答案】锥形瓶 BF 2KMnO4![]() K2MnO4+MnO2+O2↑ 可随时控制反应的速率; 吸收多余的氨气,防止造成空气污染
K2MnO4+MnO2+O2↑ 可随时控制反应的速率; 吸收多余的氨气,防止造成空气污染
【解析】
(1)由图可知,仪器①的名称是锥形瓶,故填锥形瓶。
(2)用高锰酸钾制取氧气是加热固体制取气体,应选用固体受热发生装置,即B,收集较纯净的氧气应选择排水法,故填BF;
高锰酸钾在加热的条件下反应生成锰酸钾、二氧化锰和氧气,故反应的化学方程式写为:2KMnO4![]() K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。
(3)装置A可以通过分液漏斗随时控制滴加液态反应物的速率,进而控制反应的速率,故填可随时控制反应的速率。
(4)氨气是一种污染性气体,极易溶解于水,利用装置F可以吸收多余的氨气,防止造成空气污染,故填吸收多余的氨气,防止造成空气污染。

 备战中考寒假系列答案
备战中考寒假系列答案【题目】根据下表回答问题。
温度(℃) | 20 | 40 | 50 | 60 | 80 | |
溶解度 (g/100g 水) | NaCl | 36.0 | 36.6 | 37.0 | 37.3 | 38.4 |
NH4Cl | 37.2 | 45.8 | 50.4 | 55.2 | 65.6 | |
KNO3 | 31.6 | 63.9 | 85.5 | 110 | 169 | |
(1)上表中的三种物质在20℃时,___________的溶解度最大;
(2)将40 ℃时NH4Cl和NaCl的两种饱和溶液升温至60 ℃,则两种溶液的溶质质量分数大小关系是:NaCl_____NH4Cl(填写“>”、“<”或“=”)。
(3)饱和KNO3 溶液中混有少量的NaCl,要得到KNO3 晶体的方法是_______。
(4)A是80℃含有120 g水的KNO3溶液。经过如下操作,得到102 gKNO3固体。
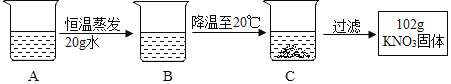
对以上过程的分析,正确的是__________(选填编号)。
① A到B的过程中,溶质质量没有改变
② B中溶质与溶剂的质量比为 169:100
③ 开始析出KNO3固体的温度在60℃至80℃之间
④ A溶液的质量等于222 g