题目内容
【题目】二氧化硅(SiO2)可用于制造分离膜,利用“膜分离”技术二氧化碳被氨水吸收转化为可做氮肥的碳酸氢铵(NH4HCO3)。
(1)SiO2中硅元素的化合价为________;
(2)保持二氧化碳化学性质的最小粒子是___________(填具体粒子名称);
(3)氧离子的结构示意图如下,则x=__________。
![]()
(4)分析过氧化氢(H2O2)和过氧化钠(Na2O2)中氧元素的化合价,可写出过氧化钙的化学式为_____。
【答案】+4 二氧化碳分子 8 CaO2
【解析】
(1)在化合物中,氧元素通常显-2价,且化合物中正负元素化合价的代数和为零,设其中硅元素的化合价为x,则:x+(-2)×2=0,x=+4;
(2)二氧化碳是由分子构成的,分子是保持物质化学性质的最小粒子;
(3)氧元素是8号元素,其核内的质子数为8;
(4)分析过氧化氢(H2O2)和过氧化钠(Na2O2)中氧元素的化合价可以发现,氧元素的化合价为-1,故过氧化钙的化学式为CaO2。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在一定条件下,甲、乙、丙、丁四种物质在一密闭容器中充分反应,测得反应前后各物质的质量如表所示。根据表中信息判断下列说法正确的是
物 质 | 甲 | 乙 | 丙 | 丁 |
反应前的质量 | 2 | 30 | 20 | 10 |
反应后的质量 | m | 39 | 5 | 16 |
A.该反应是化合反应B.甲一定是该反应的催化剂
C.反应过程中乙、丙变化的质量比为3:5D.丙可能是单质
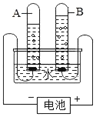
【题目】某化学兴趣小组在实验室里进行电解水实验。
(基础实验)如图所示,在电解器玻璃管里加满水(水中加入少量氢氧化钠),接通直流电源,一段时间后断开电源。用燃着的木条分别在两个玻璃管尖嘴口检验电解反应中产生的气体。

(1)打开管a活塞,观察到_________________。
(2)该实验说明水是由__________________组成的。
(3)电解水的反应属于基本反应类型中的___________。请从分子、原子的角度,分析该反应的实质:_______________。
(提出问题)理论上电解水生成氢气与氧气的体积比为2︰1,实际测定结果却往往大于2︰1。这是为什么?
(查阅资料)常温常压下,1L水中最多能溶解约31mL氧气、18mL氢气。
(探究实验)分别选用不同的电极材料进行电解水实验,3分钟后记录实验数据如下表:
电极材料 | 铜丝 | 铁丝 | 保险丝 | 电阻丝 |
氢气与氧气的体积比 | 7.7︰3.3 | 6.5︰3.2 | 6.9︰2.9 | 7.3︰3.4 |
(实验分析)下列关于电解水实验的说法中,正确的是____________(填字母)。
A水中加入少量氢氧化钠以增强导电性
B铜丝作为电极时,测得的氢气与氧气的体积比最接近2︰1
C选用不同的电极材料进行实验,可能影响测得的气体体积比
D氢气与氧气在水中溶解能力不同,可能影响测得的气体体积比
(拓展延伸)该小组同学用氯化钠代替氢氧化钠加入水中进行电解水实验,结果发现管a中收集到的气体呈黄绿色,已知该气体是一种单质,请完成发生反应的化学方程式:2NaCl+2H2O![]() H2↑+__________。
H2↑+__________。
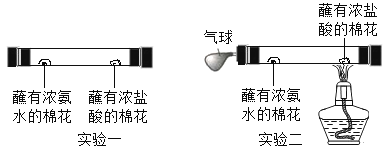
【题目】某同学进行下图两个实验。
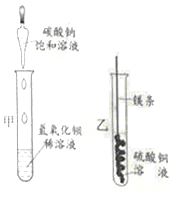
(l)甲实验中反应的化学方程式为____________;
(2)乙实验观察到的现象是___________,溶液由蓝色变成无色。
(3)把甲、乙反应后的溶液倒入同一烧怀,发现有白色沉淀生成。他决定对白色沉淀的成分进行探究。
【查阅资料】硫酸钡不溶于酸。
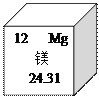
【提出猜想】 白色沉淀为:Ⅰ._______;Ⅱ.Mg(OH)2和BaSO4;Ⅲ.Mg(OH)2和MgCO3.
【实验方案】
实验操作 | 实验现象与结论 |
过滤、洗涤白色沉淀备用;向白色沉淀中加入盐酸至过量 | ①若沉淀全部溶解,且无其它现象;猜想Ⅰ成立;其化学反应方程式为____________。 ②若______且无气体产生,猜想Ⅱ成立。 ③若沉淀完全溶解,________,猜想Ⅲ成立。 |
【拓展与思考】如果猜想Ⅲ成立,产生此结果的原因是做甲实验时___________;上述白色沉淀的成分不可能出现的组合是Mg(OH)2、MgCO3和BaSO4,原因是__________________。