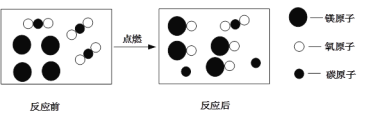
题目内容
【题目】某兴趣小组利用传感器对二氧化碳的性质进行再探究。实验步骤如下:
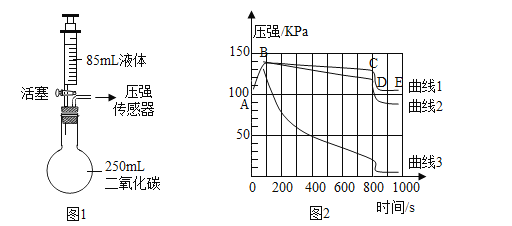
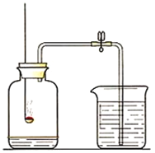
(1)如图1所示装置的气密性良好,三瓶250mL的烧瓶内收集满CO2,三个注射器内各装有85ml的液体(分别是水、饱和石灰水、40%的氢氧化钠溶液)。连接好装置和压强传感器。
(2)三位同学同时迅速将注射器内85mL的液体(水、饱和石灰水、40%的氢氧化钠溶液)注入各自烧瓶中,关闭活塞。
(3)一段时间后,同时振荡烧瓶。观察传感器定量实时地传回烧瓶内气压变化形成的图情况如图2所示。请回答下列问题:
1)导致曲线1中CD段气压“急速”减少的操作是_____。不改变装置药品情况下,进一步降低E点的方法是_____。
2)曲线2代表加入的是_____。
3)曲线3中发生反应的化学方程式为_____。曲线2 与曲线3差异较大的原因是_____。
4)对比曲线1、2、3,不能得出的结论是_____。
①CO2能与水发生反应
②吸收CO2用NaOH溶液比较合适
③CO2能与NaOH溶液反应
④检验CO2用饱和澄清石灰水较合适
【答案】振荡烧瓶使烧瓶内物质冷却饱和石灰水CO2+2NaOH=Na2CO3+H2O饱和石灰水浓度太低(氢氧化钙微溶于水)影响了二氧化碳的吸收①④
【解析】
根据图2可知,曲线3代表的反应最剧烈,吸收的CO2最多,故曲线3代表加入的是氢氧化钠溶液,曲线1代表的反应最微弱,吸收的CO2最少,故曲线1代表加入的是水,曲线2代表加入的是澄清石灰水。
1) 曲线1代表的是二氧化碳溶于水的过程,若振荡试管,则会加速反应的进行,使烧瓶内气压急速减小。E点表示的是反应结束以后烧瓶内的压强,若要进一步降低烧瓶中的压强,可以降低烧瓶内物质的温度。
2)根据上述分析可知,曲线2代表加入的是澄清石灰水。
3) 曲线3代表加入的是氢氧化钠溶液,此时发生的是氢氧化钠与二氧化碳的反应:CO2+2NaOH=Na2CO3+H2O。澄清石灰水的主要成分为氢氧化钙,虽然氢氧化钙也能与二氧化碳发生反应,但是氢氧化钙的溶解度很小,故澄清石灰水能吸收的二氧化碳很少,速率也慢。
4)图2只能表明二氧化碳能溶于水,但不能证明二氧化碳与水发生了化学反应,①错误;该实验中将氢氧化钠溶液注入二氧化碳气体中后,烧瓶内压强急剧减小,可以证明CO2能与NaOH溶液反应,且反应十分迅速,所以可以用NaOH溶液来吸收CO2,②③正确;用饱和澄清石灰水能检验二氧化碳是因为二者反应生成了白色沉淀,根据曲线2仅可知二氧化碳能被氢氧化钙溶液吸收,但并未反映出其实验现象,故④错误。故选①④。