题目内容
【题目】某研究小组对影响过氧化氢分解反应速率的某些因素进行实验探究。
(1)探究H2O2溶液的浓度对其分解反应速率的影响
【实验1】用50mL不同浓度的H2O2溶液进行实验,测定各次收集到100mL氧气时所用的时间,记录数据如下(其他实验条件如温度、催化剂种类和用量等均相同):
实验次序 | 1 | 2 | 3 | 4 | 5 |
H2O2溶液浓度 | 1% | 5% | 15% | 25% | 30% |
所用时间/s | 660 | 205 | 25 | 4 | 3 |
该反应的化学方程式为_________。
请分析:当其它条件一定时,H2O2溶液的浓度对H2O2分解制氧气反应速率的影响是 。
(2)【实验2】用30mL10%的H2O2溶液进行实验,测定各次收集到500mL氧气时所用的时间,结果如下(其他实验条件如温度等均相同同):
实验次序 | 1 | 2 | 3 | 4 | 5 |
MnO2用量/g | 0.2 | 0.4 | 0.6 | 1.0 | |
所用时间/s | 8 | 5 | 3 | 2 | 2 |
此实验的目的是探究 对过氧化氢分解制氧气反应速率的影响。
【答案】(1)2H2O2![]() 2H2O+O2↑ H2O2溶液的浓度越高,反应速率越大(2)催化剂MnO2的用量
2H2O+O2↑ H2O2溶液的浓度越高,反应速率越大(2)催化剂MnO2的用量
【解析】
试题分析:(1)用过氧化氢制取氧气的化学方程式为:2H2O2![]() 2H2O+O2↑ 由表中信息可知,H2O2溶液的浓度越高,收集到100mL氧气时所用的时间越短,即H2O2溶液的浓度越高,反应速率越大
2H2O+O2↑ 由表中信息可知,H2O2溶液的浓度越高,收集到100mL氧气时所用的时间越短,即H2O2溶液的浓度越高,反应速率越大
(2)催化剂在反应物中的含量也影响反应速率。

【题目】同学们查阅资料,镁是一种化学性质非常活泼的金属,可以在多种气体中燃烧。同学们用下图所示装置分别进行镁条在二氧化碳和氮气中燃烧的实验。B中观察到镁冒出淡黄色的烟,并闻到刺激性气味。同学们对两个反应进行了探究。
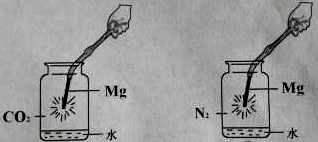
A B
[查阅资料]
①氧化镁、碳酸镁均可以和盐酸反应。
②氮化镁(Mg3N2),淡黄色固体,无味,遇水产生白色沉淀氢氧化镁,并产生有刺激
性气味的氨气(NH3)。
实验1探究A中生成黑色固体和白烟的成分。
[猜想与假设]1、黑色固体是炭。
2、白烟可能是MgO 、MgCO3或
[进行实验]
实验操作 | 实验现象 | 实验结论 |
①取A中生成的固体于试管中,加入适量稀盐酸 | 白色固体消失,无气泡生成。 | 。 |
②将①反应后的剩余物过滤,将滤渣洗涤干燥后在盛有氧气的集气瓶中点燃,熄灭后,向瓶中倒入澄清石灰水 | 黑色固体燃烧,发白光,放热,澄清石灰水变浑浊。 | 黑色固体是炭。 写出该实验中澄清石灰水发生反应的化学方程式 。 |
实验2 探究B中闻到刺激性气味的原因。
同学们根据查阅的资料分析,镁条在氮气中燃烧闻到刺激性气味的原因与集气瓶中的水有关。请你在已有实验的基础上,设计一个实验方案证明同学们的猜想正确。
。
[反思与评价]
通过探究,同学们对燃烧和灭火有了新的认识 。
【实际应用定量分析】
