题目内容
【题目】(12分)利用海水(含氯化钠、氯化镁)处理含二氧化硫废气的方法如下:
Ⅰ.海水处理流程:
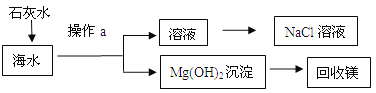
(1)写出生成Mg(OH)2沉淀的化学反应方程式 ;
(2)经操作a得到的Mg(OH)2沉淀需要洗净,为证明是否洗净,可取洗涤液少量,向其
中加入下列试剂中的 ,即可达到实验目的。
A. Na2CO3溶液 B.石灰水 C. 硝酸银溶液
Ⅱ.处理二氧化硫流程:
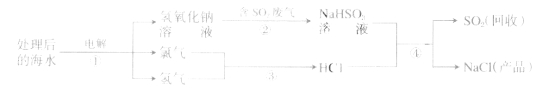
(3)上图中最终得到“NaCl”的过程属于 (填“物理变化”或“化学变化”);
(4)图中反应①、③、④属于化合反应的是 (填序号);
(5)①中反应的化学方程式为 ;
(6)④中反应的化学方程式为 。
【答案】(1)MgCl2+Ca(OH)2=== Mg(OH)2↓+ CaCl2 (2)A、C
(3)物理变化 (4)③ (5)2NaCl+2H2O通电NaOH+2H2↑+Cl2↑
(6)NaHSO3+HCl===NaCl+SO2+H2O
【解析】
试题分析:(1)海水中的氯化镁能与石灰水反应,生成Mg(OH)2沉淀,反应的化学方程式:MgCl2+Ca(OH)2=== Mg(OH)2↓+ CaCl2
(2)经操作a得到的Mg(OH)2沉淀中可能粘有MgCl2或Ca(OH)2,为证明是否洗净,实际上就是检验洗涤液中是否含有MgCl2或Ca(OH)2,故向其中加入下列试剂中的Na2CO3溶液或硝酸银溶液,故选A、C
(3)上图中最终得到“NaCl”的过程,是采用蒸发溶剂的方法,属于物理变化
(4)图中反应①是通电得到三种物质,反应③是氢气和氯气反应生成氯化氢,属于化合反应,反应④是两种化合物反应生成另两种化合物,属于复分解反应,故选③
(5)根据流程图,①中反应的化学方程式为:2NaCl+2H2O通电NaOH+2H2↑+Cl2↑
(6)④中反应的化学方程式为:NaHSO3+HCl===NaCl+SO2+H2O