题目内容
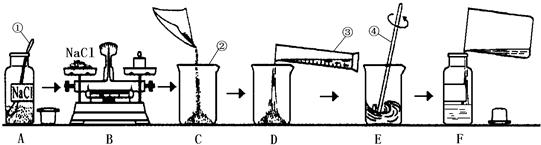
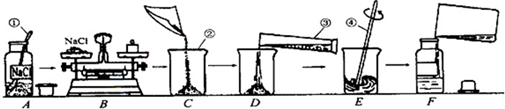
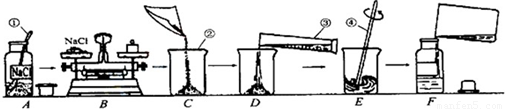
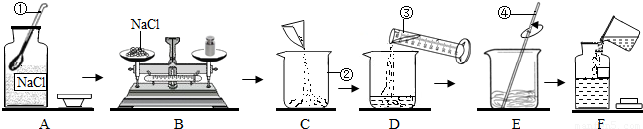
为监测某厂排放污水中的银离子的含量,需配制50g质量分数为15%的氯化钠溶液,如图是某同学配制溶液的操作过程.
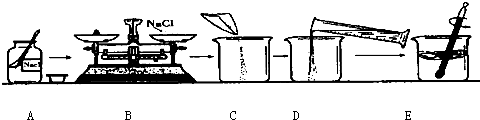
(1)请指出图中操作中的三处错误:①
②
③
(2)B操作中应称量氯化钠的质量是
(3)E操作的作用
(4)如图操作中,可能导致溶质质量分数

(1)请指出图中操作中的三处错误:①
A中瓶塞正放在了桌子上
A中瓶塞正放在了桌子上
;②
B中称量物体和砝码放反了
B中称量物体和砝码放反了
;③
E中用温度计搅拌
E中用温度计搅拌
.(2)B操作中应称量氯化钠的质量是
7.5
7.5
g,D操作中量筒的规格应为50
50
(填“10”“50”或“100”)mL.(3)E操作的作用
加快溶解
加快溶解
;(4)如图操作中,可能导致溶质质量分数
偏低
偏低
(填偏高、偏低、不变).分析:(1)根据瓶塞取下后要倒放的原则;称量时左物右码的原则;搅拌要用玻璃棒,不能用温度计解答;
(2)根据溶液中溶质质量=溶液质量×溶质质量分数求出需要食盐的质量,然后根据溶液的质量=溶质质量+溶剂质量求出所需溶剂水的体积即可确定量筒的规格;
(3)根据搅拌能加快溶解速度解答;
(4)根据溶质质量分数=
×100%分析.
实验中量筒在读数时应平视,若仰视读数,读数偏小,实际量取的液体偏多,俯视读数读数偏大,实际量取的液体体积偏少.
(2)根据溶液中溶质质量=溶液质量×溶质质量分数求出需要食盐的质量,然后根据溶液的质量=溶质质量+溶剂质量求出所需溶剂水的体积即可确定量筒的规格;
(3)根据搅拌能加快溶解速度解答;
(4)根据溶质质量分数=
| 溶质质量 |
| 溶液质量 |
实验中量筒在读数时应平视,若仰视读数,读数偏小,实际量取的液体偏多,俯视读数读数偏大,实际量取的液体体积偏少.
解答:解:(1)A中瓶塞正放在了桌子上;B中称量物体和砝码放反了;E中用温度计搅拌,温度计只能测量温度不能用于搅拌;故答案:
A中瓶塞正放在了桌子上;B中称量物体和砝码放反了;E中用温度计搅拌故选A、应将瓶塞倒放在桌子上.
(2)所需氯化钠的质量为50g×15%=7.5g,所需水的质量为50g-7.5g=42.5g合42.5mL水,所以选用50mL的量筒;故答案:7.5;50
(3)玻璃棒搅拌目的是加速溶质的溶解,故答案:加速溶解;
(4)称量时食盐和砝码放反了使称量的食盐的质量小于7.5g,所以配制的溶液溶质质量分数偏小,故答案:偏低.
A中瓶塞正放在了桌子上;B中称量物体和砝码放反了;E中用温度计搅拌故选A、应将瓶塞倒放在桌子上.
(2)所需氯化钠的质量为50g×15%=7.5g,所需水的质量为50g-7.5g=42.5g合42.5mL水,所以选用50mL的量筒;故答案:7.5;50
(3)玻璃棒搅拌目的是加速溶质的溶解,故答案:加速溶解;
(4)称量时食盐和砝码放反了使称量的食盐的质量小于7.5g,所以配制的溶液溶质质量分数偏小,故答案:偏低.
点评:在配制一定质量分数的溶液的实验中既考察了溶液的配制又考察的基本操作,增加了学生的动手能力.

练习册系列答案
相关题目