题目内容
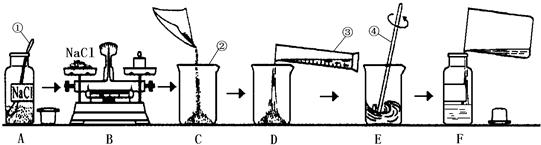
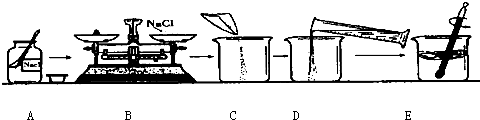
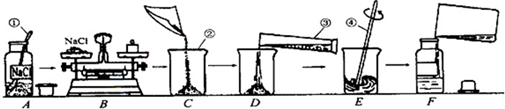
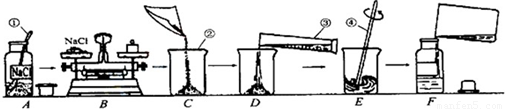
为监测某厂排放污水中的银离子的含量,需配制50克质量分数为5%的氯化钠溶液,下图是某同学配制溶液的操作过程.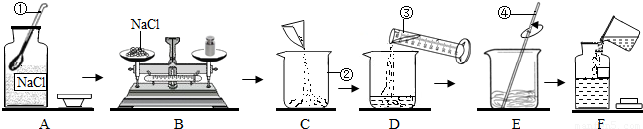
(1)写出标号①-④各仪器的名称:①______②______③______④______
(2)A操作中的错误______.
(3)B操作中应称量氯化钠的质量是______克,称量时若指针偏左,应进行的操作是______.
(4)D操作中仪器③的规格应为______(填“10”“50”或“500”)毫升.
(5)E操作的作用______.
(6)下列错误操作中,可能导致溶质质量分数偏低的是______(填序号)
①B操作中砝码和氯化钠放错托盘
②D操作中有少量水溅出
③D操作中仰视凹液面最低处读数
④F操作中溶液洒落.
【答案】分析:根据溶液质量和质量分数可分别求出溶质质量和溶剂质量.取用药品时:块状固体用镊子、粉末状用药匙、液体用胶头滴管,瓶塞倒扣在桌面上.称取固体用托盘天平(使用前校零、使用时垫质量相等的纸片、左物右码),量取液体用烧杯,溶解中为加快溶解,要使用玻璃棒搅拌.由溶质的质量分数公式得:溶质质量变大,质量分数变大,溶液质量变大,质量分数变小
解答:解:(1)仪器的名称,答案为:药匙 烧杯 量筒 玻璃棒
(2)A中错误为:瓶塞应倒扣在桌面上
(3)溶质的质量=溶液的质量×溶质的质量分数=50g×5%=2.5g,根据托盘天平的原理:m(物体)=m(砝码)+m(游码),指针偏左,则物体质量较大,即氯化钠的质量偏大,故答案为:2.5g 取出多余的NaCl固体,直至天平平衡
(4)溶剂水的质量为50g-2.5g=47.5g,通过密度可求算出水的体积为47.5ml,使用50ml的量筒量取,故答案为:50mL(5)E操作为搅拌,搅拌的目的是加速溶解,故答案为:加速氯化钠固体溶解
(6)溶质的质量偏小或溶液的质量偏大会导致溶质的质量分数偏小,①中氯化钠质量偏小、②中水溅出,导致溶液质量偏小、③中溶剂体积偏大,溶液质量偏大、④中溶液已配制完成,质量分数已定,无影响,故答案为:①③
点评:本题考查了溶液配制的步骤、仪器的名称、溶质质量的求算以及实验的误差分析.
解答:解:(1)仪器的名称,答案为:药匙 烧杯 量筒 玻璃棒
(2)A中错误为:瓶塞应倒扣在桌面上
(3)溶质的质量=溶液的质量×溶质的质量分数=50g×5%=2.5g,根据托盘天平的原理:m(物体)=m(砝码)+m(游码),指针偏左,则物体质量较大,即氯化钠的质量偏大,故答案为:2.5g 取出多余的NaCl固体,直至天平平衡
(4)溶剂水的质量为50g-2.5g=47.5g,通过密度可求算出水的体积为47.5ml,使用50ml的量筒量取,故答案为:50mL(5)E操作为搅拌,搅拌的目的是加速溶解,故答案为:加速氯化钠固体溶解
(6)溶质的质量偏小或溶液的质量偏大会导致溶质的质量分数偏小,①中氯化钠质量偏小、②中水溅出,导致溶液质量偏小、③中溶剂体积偏大,溶液质量偏大、④中溶液已配制完成,质量分数已定,无影响,故答案为:①③
点评:本题考查了溶液配制的步骤、仪器的名称、溶质质量的求算以及实验的误差分析.

练习册系列答案
 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目