题目内容
【题目】化工厂用废硫酸制备K2SO4的流程如图:
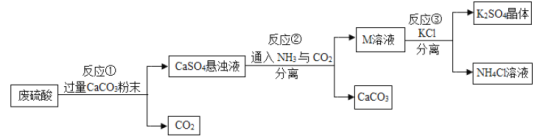
(1)反应①可用化学方程式表示为_____;
(2)流程中,两次将固体与溶液分离开的操作名称是_____;
(3)反应②后得到的M溶液中的溶质是_____。
【答案】CaCO3+H2SO4=CaSO4↓+H2O+CO2↑ 过滤 硫酸铵
【解析】
硫酸和碳酸钙反应生成微溶的硫酸钙和水以及二氧化碳,反应②后得到的M溶液中的溶质和氯化钾反应生成硫酸钾和氯化铵。
(1)反应①是硫酸和碳酸钙反应生成微溶的硫酸钙和水以及二氧化碳,对应的化学方程式表示为![]() 。
。
(2)流程中,两次将固体与溶液分离开的操作名称是过滤。
(3)反应②后得到的M溶液中的溶质和氯化钾反应生成硫酸钾和氯化铵,根据质量守恒定律以及复分解反应的特点,可知溶质应该是硫酸铵。

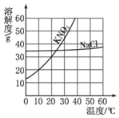
【题目】生理盐水是0.9%的氯化钠水溶液,因为它的渗透压值和正常人的血浆、组织液都是大致一样的,所以可以用作补液以及其他医疗用途。已知氯化钠在不同温度时的溶解度如下表所示:
温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
溶解度/g | 35.7 | 35.8 | 36.0 | 36.6 | 37.3 | 38.4 |
下列说法中不正确的是( )
A. 氯化钠的溶解度随着温度的升高而增大
B. 20℃时的生理盐水是氯化钠的不饱和溶液
C. 将80℃时的氯化钠的饱和溶液冷却至20℃,有结晶现象
D. 40℃时,100g氯化钠的饱和溶液中氯化钠的质量为36.6g
【题目】我校兴趣小组对废旧的干电池进行探究,同学们首先将干电池剖开发现有一层白色糊状物质,并闻到一股氨味。
(提出问题)白色糊状物的成分是什么?
(提供资料)
① 干电池的内部结构见如图,白色糊状物质A中除了含有淀粉,还含有一种盐,且该盐中阴离子是SO42-、CO32-、Cl-中的一种。
② 碘溶液能使淀粉变蓝。
③ 氨气可以使湿润的红色石蕊试纸变蓝。
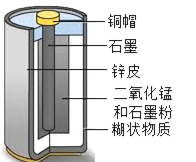
(进行猜想)A中含有淀粉,A中的盐可能是铵盐。
(实验一)取少量A于试管中,滴加少量碘溶液,观察到_______________,证明A中含有淀粉。
(实验二)取少量A于研钵中,加入_____________固体,混合、研磨,产生刺激性气味的气体,该气体能使湿润的红色石蕊试纸变蓝,证明A中含有铵根离子。
(实验三)为了验证其阴离子的存在情况,兴趣小组再次设计如下实验,请你完成以下实验报告。
实验操作 | 实验现象 | 实验结论 |
(1)取糊状物少量,加足量的水,搅拌后过滤。取少量滤液于试管中,滴加氯化钡溶液。 | 无现象 | ________________ |
(2)另取第(1)步所得滤液少量,滴加少量_____________溶液 | 产生白色沉淀 | 存在的离子是Cl- |
(得出结论)上述实验证明,电池内白色糊状物含有淀粉和氯化铵两种物质。
(反馈交流)兴趣小组指导老师指出实验三的方案设计存在错误,请你说明错误的原因并将其改正:___________________________。
(知识应用)回收废旧干电池不仅可以减少环境污染,还能变废为宝。根据上述探究过程,请简要说明干电池中的白色糊状物的回收价值有:__________________________________。