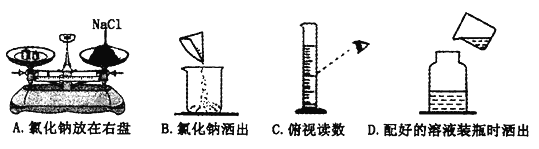
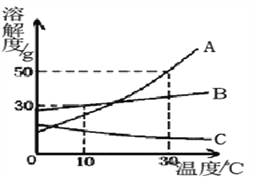
题目内容
【题目】化学实验课上,同学们想用7.3%的稀盐酸来测定某氢氧化钠溶液中溶质的质量分数。在老师指导下,甲同学取了20g氢氧化钠溶液进行了数字化实验,由计算机描绘出了整个实验过程中溶液pH的变化图象(如下图)。
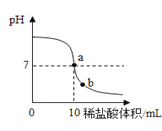
请回答:
﹙1﹚图中a点表示的含义是_____;b点溶液中含有的阳离子是______(填离子符号);
﹙2﹚甲同学要计算出这瓶氢氧化钠溶液中溶质的质量分数,除了已有数据外,你认为还需要补充的数据是_______。乙组同学在滴加稀盐酸一段时间后,发现溶液中有少量气泡产生.这一“异常现象”激起了他们的探究欲望,通过实验证明:该组用的这瓶氢氧化钠溶液已经部分变质。请用化学方程式表示其变质的原因___________。
【答案】 氢氧化钠和稀盐酸恰好完全反应 Na+、H+ 稀盐酸的密度 2NaOH + CO2 = Na2CO3 + H2O
【解析】(1)由图可知,a点时溶液的pH值为7,此时氢氧化钠和稀盐酸恰好完全反应;b点溶液中的溶质是氯化钠和盐酸,故含有的阳离子是Na+、H+ ;
(2)溶液中溶质的质量分数是用溶质质量来计算的,要求消耗氢氧化钠溶液的质量分数,必须要计算需要氢氧化钠的质量,故要知道参加反应的盐酸中溶质的质量,已经知道消耗稀盐酸的体积和质量分数,故还需要稀盐酸的密度才能计算出稀盐酸中溶质的质量;氢氧化钠的变质是氢氧化钠与二氧化碳反应生成碳酸钠和水,反应方程式为:2NaOH + CO2 = Na2CO3 + H2O;

 阅读快车系列答案
阅读快车系列答案【题目】某同学在实验室通过实验对草酸进行如下研究。
【查阅资料】①无水硫酸铜吸水后由白色变为蓝色
②氯化钯(PdCl2)溶液遇CO产生黑色沉淀
【实验准备】选用下列实验装置(气密性良好,部分固定装置已略去):
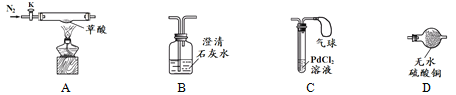
【实验探究】检验草酸分解的产物。
实验步骤 | 实验现象 | 实验结论及分析 |
(1)按A→D→B→C连接仪器 (2)关闭K,点燃A处酒精灯 | D中_________________B中澄清石灰水变浑浊C中产生黑色沉淀,气球鼓起 | 草酸分解生成了CO2、CO和H2O B中反应的化学方程式是:_______________________ ②C中气球的作用是__________ |
【题目】甲、乙、丙三种物质的转化关系如图所示(“→、←”表示反应一步实现,部分物质和反应条件已略去)。下列选项不能实现图示转化的是
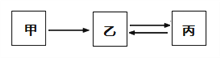
选项 | 甲 | 乙 | 丙 |
A | H2SO4 | H2 | H2O |
B | C | CO | CO2 |
C | Fe2O3 | Fe | Fe3O4 |
D | CaO | Ca(OH)2 | CaCO3 |
A. A B. B C. C D. D