题目内容
过量的铁粉与稀盐酸反应,实验时观察到有气泡产生,溶液由无色变成浅绿色.(1)写出反应的化学方程式;
(2)反应后溶液中主要含有Cl-、、(填粒子符号);
(3)从资料中得知:溶液的颜色通常是由溶液中的粒子决定的.由此你认为该反应后溶液呈浅绿色是由(填粒子符号)表现出来的,验证的实验方案或事实是.
【答案】分析:(1)根据铁与盐酸的化学反应原理作答即可;
(2)根据溶液的组成分析即可;
(3)Fe2+显绿色,再根据溶液组成与颜色分析即可.
解答:解:(1)铁会与盐酸反应放出氢气,故答案为:Fe+2HCl=H2↑+FeCl2;
(2)铁与盐酸反应生成氯化亚铁溶液,氯化亚铁在水中会电离出Cl-、Fe2+,溶剂为水(H2O),
故答案为:Fe2+、H2O;
(3)因为稀盐酸无色,所以H+、Cl-无色;因为氯化亚铁溶液显绿色,它含的离子有:Cl-、Fe2+,而Cl-无色,所以Fe2+显绿色;
故答案为:Fe2+、反应前的盐酸溶液是无色的.
点评:有些离子是有颜色的,如Fe2+显绿色,Fe3+显黄色,Cu2+显蓝色,同学们需要注意这些离子的特殊颜色.
(2)根据溶液的组成分析即可;
(3)Fe2+显绿色,再根据溶液组成与颜色分析即可.
解答:解:(1)铁会与盐酸反应放出氢气,故答案为:Fe+2HCl=H2↑+FeCl2;
(2)铁与盐酸反应生成氯化亚铁溶液,氯化亚铁在水中会电离出Cl-、Fe2+,溶剂为水(H2O),
故答案为:Fe2+、H2O;
(3)因为稀盐酸无色,所以H+、Cl-无色;因为氯化亚铁溶液显绿色,它含的离子有:Cl-、Fe2+,而Cl-无色,所以Fe2+显绿色;
故答案为:Fe2+、反应前的盐酸溶液是无色的.
点评:有些离子是有颜色的,如Fe2+显绿色,Fe3+显黄色,Cu2+显蓝色,同学们需要注意这些离子的特殊颜色.

练习册系列答案
相关题目
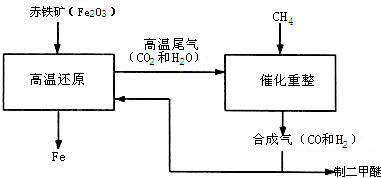
 CO+H2 ③CO+H2O==CO2+H2
CO+H2 ③CO+H2O==CO2+H2






