题目内容
为了测定盐湖析出的一定量Na2CO3中NaCl的质量,向10.9gNa2CO3(含少量NaCl)的混合物中滴加14.6%的稀盐酸至恰好完全反应时,并收集气体4.4g,回答下列问题:
(1)写出题中发生反应的化学方程式 ;
(2)根据已知条件列出求解Na2CO3质量(x)的比例式 或 ;
(3)10.9g样品中含NaCl的质量为 g;
(4)反应后向所得溶液中加入23.5g水,则其中溶质质量分数为 .
(1)Na2CO3+2HCl═2NaCl+H2O+CO2↑ (2)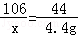 或
或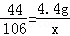 ;(3)0.3g;(4)15%
;(3)0.3g;(4)15%
解析试题分析:
(1)碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑
(2)设样品中碳酸钠的质量为x,生成氯化钠的质量为y,消耗HCl的质量为z
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 117 44
x z y 4.4g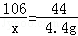
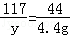
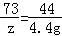
X=10.6g y=11.7g z=7.3g
反应掉的盐酸的质量=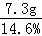 =50g
=50g
(3)样品中氯化钠质量为10.9g﹣10.6g=1=0.3g
(4)反应后的溶液中溶质氯化钠质量=0.3g+11.7g=12g
反应后的溶液中溶液的质量=10.9g+50g+23.5g﹣4.4g=80g
反应后溶液的溶质质量分数 ×100%=15%
×100%=15%
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算.

 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案碘元素与人体健康息息相关,是维持人体甲状腺正常功能所必需的元素。当人体缺碘时就会甲状腺肿大,俗称“大脖子病”。
(1)碘的元素符号为 ,属于 (填“金属元素”或“非金属元素”);
(2)右图是某品牌食盐包装。若某成人每天需补充碘元素的质量为0.25mg,假如碘的摄取完全来自于该品牌食盐,试计算该成人每天至少摄入食盐的质量为多少Kg?
| 配料 | 氯化钠、碘酸钾 |
| 碘元素含量 | 20—30mg/Kg食盐 |
| 保质期 | 18个月 |
| 使用方法 | 勿长时间炖炒 |
| 贮存指南 | 避光、避热、密封、防潮 |
 是1.67
是1.67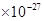 kg,又知氧的相对原子质量是16,一个氢原子的质量约为1.674
kg,又知氧的相对原子质量是16,一个氢原子的质量约为1.674