题目内容
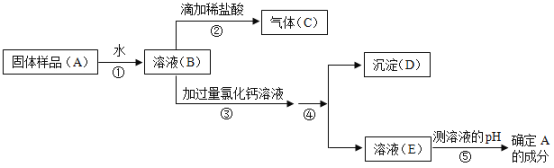
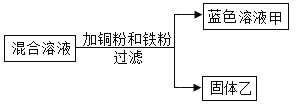
【题目】电子工业常用30%的FeCl3溶液腐蚀覆盖有一薄层铜的绝缘板,制成印剧电路板。人们为了从废腐蚀液(含有CuCl2、FeCl2和FeCl3)中回收铜,并重新得到FeCl3溶液,设计如下实验流程。(已知:2FeCl3+Fe=3FeCl2)
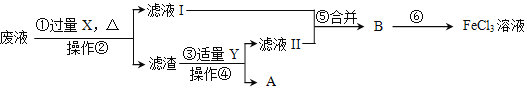
(1)操作②、④的名称是___________。
(2)上述流程中,X的化学式为________,步骤③中有关反应的化学方程式为________。
(3)在工业生产中,步骤⑥的通常做法是向B中通入氯气,而在实验室向B中滴加适量过氧化氢溶液,也可以达到相同的效果。工业完成步骤⑥的反应属于_________(填基本反应类型),实验室完成步骤⑥的化学方程式是________。
【答案】过滤 Fe Fe+2HCl=FeCl2+H2↑ 化合 FeCl2+2HCl+H2O2=2FeCl3+2H2O
【解析】
(1)操作②、④的名称是过滤,通过过滤把液体和不溶于水的固体分离;
(2)上述流程中,加入的过量物质X是铁粉,铁的化学式为Fe,滤渣中所含的物质是反应生成的铜和过量的铁粉,铜的化学式是Cu;步骤③中,加入的适量的Y是稀盐酸,稀盐酸能和铁反应生成氯化亚铁和氢气,反应的化学方程式为:Fe+2HCl═FeCl2+H2↑;
(3)氯化亚铁和氯气反应的化学方程式为:2FeCl2+Cl2═2FeCl3,反应符合“多变一”的特点,属于化合反应;实验室向B中滴加适量过氧化氢溶液,可以将氯化亚铁氧化为氯化铁,化学方程式为:2FeCl2+2HCl+H2O2═2FeCl3+2H2O。

练习册系列答案
相关题目