��Ŀ����
�������⣨H2O2����ҽ���ϳ��õ�һ������Һ������ʱ�ڶ��������������������£����Է����ֽⷴӦ������һ����ɫ����ζ�����壮���������������Ϻ�ͼ����ʾװ�ã��ش��������⣺
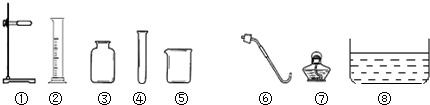
��1����Ҫ��ʵ������ȡ�������壬��ѡ�õķ���װ����______����װ����ţ�
��2�����������������������______�������ֲ����������______��
��3����Ҫ��ʵ�����ռ��������壬һ������______װ�ã���ţ�
��4�������ʵ�飬��֤��IJ��루��Ҫ����ʵ�鲽�衢����ͽ��ۣ�
______��
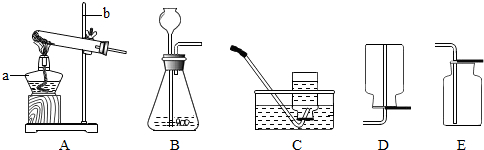
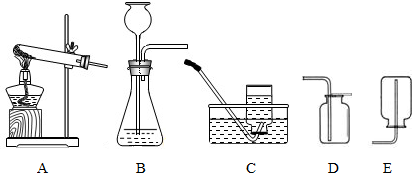
�⣺��1����Ӧ���״̬�ǹ�̬��Һ̬����Ӧ�����dz��£�Ӧѡ��--Һ�������͵ķ���װ�ã�
�ʴ�Ϊ��B
��2����ѧ��Ӧǰ��Ԫ�ص�����䣬����������������Ԫ�غ���Ԫ����ɣ��������ɵ����������������Ҳ������������
�ʴ�Ϊ����������������ѧ��Ӧǰ��Ԫ�ص�����䣬������������������Ԫ����ɣ�
��3���������ܶȱȿ�����������ˮ�����������ſ���������ˮ���ռ��������ܶ�С�ڿ������ܶȣ���������ˮ�����������ſ���������ˮ���ռ������ߵ���ͬ�ռ���������ˮ����
�ʴ�Ϊ��C��
��4��������ʹȼ�յ�ľ��ȼ�ո����������ܹ�ȼ�գ�����ʱӦ��ȼ�ŵ�ľ�����뼯��ƿ�У���ľ��ȼ�ո����������Ϊ��������������ȼ�գ��������Ϊ������
�ʴ�Ϊ������ˮ���ռ�һƿ���壬��ȼ�ŵ�ľ������ƿ�У���ľ��ȼ�ո����������Ϊ��������������ȼ�գ��������Ϊ������
��������1�����ݷ�Ӧ���״̬�ͷ�Ӧ����ȷ������װ�ã�
��2�����ݻ�ѧ��Ӧǰ��Ԫ�ص��������в²⣮
��3������������ܶȺ���ˮ��ȷ���ռ�װ�ã�
��4��������������ȼ�Ժ������Ŀ�ȼ�Խ��м��飮
������������ռ�������Ҫȡ����������ܶȺ���ˮ�ԣ����Ҫ���������Ƿ��������Ӧ���Ƿ���ˮ��Ӧ���Ƿ��ж��ȣ�
�ʴ�Ϊ��B
��2����ѧ��Ӧǰ��Ԫ�ص�����䣬����������������Ԫ�غ���Ԫ����ɣ��������ɵ����������������Ҳ������������
�ʴ�Ϊ����������������ѧ��Ӧǰ��Ԫ�ص�����䣬������������������Ԫ����ɣ�
��3���������ܶȱȿ�����������ˮ�����������ſ���������ˮ���ռ��������ܶ�С�ڿ������ܶȣ���������ˮ�����������ſ���������ˮ���ռ������ߵ���ͬ�ռ���������ˮ����
�ʴ�Ϊ��C��
��4��������ʹȼ�յ�ľ��ȼ�ո����������ܹ�ȼ�գ�����ʱӦ��ȼ�ŵ�ľ�����뼯��ƿ�У���ľ��ȼ�ո����������Ϊ��������������ȼ�գ��������Ϊ������
�ʴ�Ϊ������ˮ���ռ�һƿ���壬��ȼ�ŵ�ľ������ƿ�У���ľ��ȼ�ո����������Ϊ��������������ȼ�գ��������Ϊ������
��������1�����ݷ�Ӧ���״̬�ͷ�Ӧ����ȷ������װ�ã�
��2�����ݻ�ѧ��Ӧǰ��Ԫ�ص��������в²⣮
��3������������ܶȺ���ˮ��ȷ���ռ�װ�ã�
��4��������������ȼ�Ժ������Ŀ�ȼ�Խ��м��飮
������������ռ�������Ҫȡ����������ܶȺ���ˮ�ԣ����Ҫ���������Ƿ��������Ӧ���Ƿ���ˮ��Ӧ���Ƿ��ж��ȣ�

��ϰ��ϵ�д�
�����Ŀ
 ʵ�����г��ø���������ȷֽ���ȡ������
ʵ�����г��ø���������ȷֽ���ȡ������