题目内容
【题目】“数字化实验”丰富了实验研究的方法,它可将实验过程中某些因素(酸碱性、气压等)的变化以数据、图像的形式呈现出来。请回答:
探究二氧化碳与水的反应
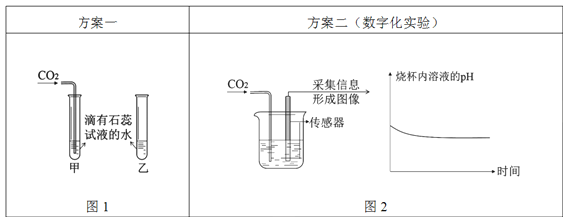
Ⅰ.图1中可观察到甲试管中的紫色液体变为_______色,写出发生反应的化学方程式_______,乙试管的作用是_______;
Ⅱ.由图2坐标图中的曲线可知,烧杯内溶液的酸性逐渐变_______(填“强”或“弱”)。
探究蜡烛燃烧的产物

Ⅰ.如图3所示,用注射器在蜡烛外焰部位抽气并振荡,可观察到_______,证明反应生成了二氧化碳;若将干冷的烧杯罩在火焰上方,观察到_______,证明反应生成了水。
Ⅱ.如图4所示,蜡烛在密闭容器内燃烧,同时监测容器内氧气、二氧化碳和水蒸气含量的变化,形成三条曲线如坐标图所示,曲线_______(选填“a”、“b”、“c”)能够说明蜡烛燃烧生成了二氧化碳和水。
③ 比较块状碳酸钙、碳酸钙粉末与稀盐酸反应的速度
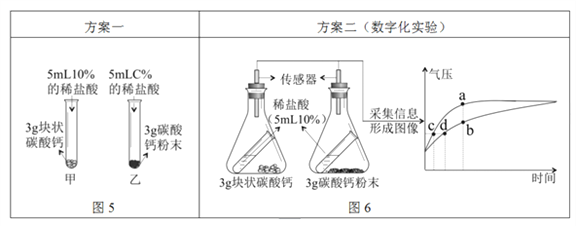
Ⅰ.写出碳酸钙与稀盐酸发生反应的化学方程式_______;
图5中,乙试管中稀盐酸的浓度C%应为_______;
较之块状碳酸钙,碳酸钙粉末与稀盐酸的反应更为剧烈,原因是_______。
Ⅱ.按图6所示进行实验,倾斜锥形瓶使小试管内的稀盐酸流入瓶中与固体接触发生反应,瓶内气压的变化如坐标图所示。对比分析坐标图中的点_______(选填a~d)可知:两个锥形瓶内达到相同的压强时,碳酸钙粉末与稀盐酸反应所需时间更短。
【答案】红CO2+H2O→H2CO3对照强石灰水变浑浊烧杯内壁有水雾(或无色小液滴)b、cCaCO3 + 2HCl→CaCl2 + H2O+CO2↑10%反应物之间的接触面积更大c、d
【解析】Ⅰ.二氧化碳能和水反应生成碳酸,酸性溶液使紫色石蕊试液变红图1中可观察到甲试管中的紫色液体变为红色,发生反应的化学方程式CO2+H2O→H2CO3 ,乙试管的作用是对照试验;Ⅱ.溶液的pH小于7,溶液呈酸性,pH越小,酸性越强;由图2坐标图中的曲线可知,烧杯内溶液的酸性逐渐变强。用注射器在蜡烛外焰部位抽气并振荡,可观察到澄清石灰水变浑浊,证明反应生成了 二氧化碳;(6)若将干冷的烧杯罩在火焰上方,观察到烧杯内壁有水雾出现,证明反应生成了水;(7) b、c两图中物质的质量增加,a图中物质的质量减少,说明蜡烛燃烧消耗氧气生成了二氧化碳和水。(8) 碳酸钙与稀盐酸生成氯化钙二氧化碳和水,反应方程式为:CaCO3 + 2HCl→CaCl2 + H2O+CO2↑,(9)根据控制变量原则的要求,甲、乙两个试管内酸的浓度应该相同,乙试管中稀盐酸的浓度C%应为10%,(10) 碳酸钙粉末与稀盐酸接触程度比块状碳酸钙与稀盐酸接触更充分,所以反应物之间的接触面积更大,更充分,所以反应速率更快;(11). c、d两点压强相同,反应时间不同,c点时间比d短,两个锥形瓶内达到相同的压强时,碳酸钙粉末与稀盐酸反应所需时间更短。

【题目】下表是NaCl、KClO3在不同温度下的溶解度(单位:g/100g水)。
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
S(NaCl) | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
S(KClO3) | 3.3 | 7.3 | 13.9 | 23.8 | 37.5 | 56.3 |
20℃时,NaCl的溶解度为_______ g/100g水;
40℃时,将10gKClO3放入100g水中充分溶解,所得溶液溶质质量分数为_______(最简分数);
③ “海水晒盐”利用的方法是_______(填“蒸发结晶”或“降温结晶”);
④ 工业上用氯化钠溶液制备氯酸钾,主要流程如下:
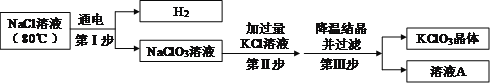
(第Ⅱ步中发生的反应:NaClO3+KCl→NaCl+KClO3)
上述流程中,氯化钠溶液中的水是否参与第Ⅰ步化学反应?_______(填“是”或“否”)。
溶液A中的溶质除NaCl外,还含有_______(填化学式)。