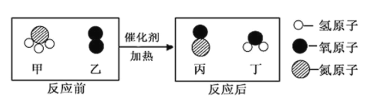
题目内容
【题目】向8.4g铁粉中先加入100g稀硫酸,然后再加入足量的硫酸铜溶液,反应过程中所得固体质量与加入物质的质量关系如图所示,下列说法正确的是

A.原稀硫酸中硫酸质量分数为9.8%
B.m值为5.6
C.b点对应的溶液质量为101.9g
D.c点对应的固体不能被磁铁吸引
【答案】BD
【解析】
向8.4g铁粉中先加入100g稀硫酸,然后再加入足量的硫酸铜溶液,最终固体为铜,Fe+CuSO4=Cu+FeSO4,反应中铁和铜的质量比为56:64,由图可知,铜的质量为6.4g,故和硫酸反应后剩余的铁的质量为5.6g,即m值为5.6;反应后固体为铜,不能被磁铁吸引;由Fe+ H2SO4 == FeSO4 + H2↑可知铁和硫酸的质量比为56:98,和硫酸反应的铁的质量为8.4g-5.6g=2.8g,所以稀硫酸中溶质的质量为4.9g,则原稀硫酸中硫酸质量分数为4.9%;由于不知道硫酸铜溶液的质量及浓度,无法确定b点对应的溶液质量。
故选BD。

练习册系列答案
相关题目
【题目】取10g石灰石样品于烧杯中,再向其中加入足量稀盐酸(杂质不反应),有关实验数据见下表:
反应前 | 反应后 | |
烧杯与稀盐酸的质量 | 石灰石样品的质量 | 烧杯和其中混合物的质量 |
160g | 10g | 166.7g |
(1)CaCO3中Ca元素的质量分数为____________。
(2)生成CO2的质量____________。
(3)求石灰石样品中碳酸钙的质量分数____________(写出计算过程)。