题目内容
【题目】食品保鲜的措施有添加防腐剂、填充气体、放置干燥剂和脱氧剂等。
(1)丙酸钠是一种食品防腐剂,化学式为 C3H5O2Na,它由_____种元素组成;若某食品中添加了4.8g 丙酸钠,则该食品中相当于添加了_____g 的钠元素。
(2)钠元素位于元素周期表中第_____周期。
(3)根据结构相似,其化学性质相似的结论,利用丙酸钠化学式,写出丙酸与氢氧化钾溶液发生中和反应的化学方程式_____。
【答案】4 1.15 三 C3H5O2H+KOH=C3H5O2K+H2O
【解析】
(1)丙酸钠是一种食品防腐剂,化学式为C3H5O2Na,它由碳、氢、氧、钠4种元素组成;若某食品中添加了4.8g 丙酸钠,则该食品中相当于添加了4.8g×![]() ×100%=1.15g的钠元素。
×100%=1.15g的钠元素。
(2)钠原子核外电子数依次为2,8,1,三个电子层,所以钠元素位于元素周期表中第三周期。
(3)根据结构相似,其化学性质相似的结论,利用丙酸钠化学式,可知丙酸的化学式为C3H5O2H,丙酸与氢氧化钾溶液发生中和反应的化学方程式 C3H5O2H+KOH=C3H5O2K+H2O。

【题目】实验室有一瓶长期放置的氢氧化钠固体,某兴趣小组同学欲对该固体变质情况进行探究。
Ⅰ.固体的成分分析
【提出问题】该瓶氢氧化钠固体是否变质,变质情况如何?
【查阅资料】①氢氧化钠在空气中容易变质但不会转化为NaHCO3;
②CaCl2溶液的pH=7。
③碱石灰是CaO和NaOH的混合物
【提出猜想】猜想Ⅰ:固体未变质,只有NaOH
猜想Ⅱ:固体全部变质,只有Na2CO3
猜想Ⅲ:固体部分变质,是NaOH 和Na2CO3 的混合物
【原因分析】氢氧化钠在空气中变质的原因是_______________(用化学方程式表示)。
【进行实验】小聪同学取少量样品于烧杯中,用足量水溶解,再向溶液中滴入几滴酚酞试液,溶液变红,由此他得出猜想Ⅰ正确,但其他同学很快予以否定,否定的理由是________________,为了进一步得出结论,组内其他三位同学分别取小聪实验后的溶液于试管中,进行如下表所示实验。
同学 | 小钱 | 小徐 | 小陆 |
实验操作 | 加入适量氢氧化钙溶液 | 加入过量氯化钙溶液 | 逐滴加入稀盐酸至过量 |
【实验结论】小钱、小徐的实验中都观察到有白色沉淀生成且溶液仍是红色,于是他们都得出猜想Ⅲ正确。
【反思评价】(一)老师指出,仅凭小钱的实验操作和现象无法确定猜想Ⅲ正确,理由是__________________。
(二)根据小徐的结论推测小陆实验现象是_________________________________。
Ⅱ 固体中各成分含量
【提出问题】如何测定变质的氢氧化钠固体中碳酸钠的质量分数?
【进行实验】化学小组同学设计了如下实验装置。
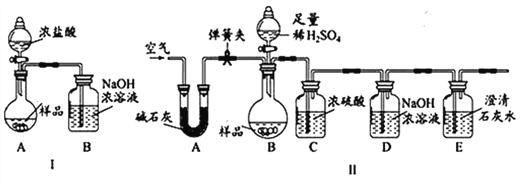
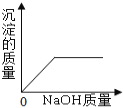
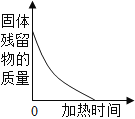
(一)小陆同学认为通过测定装置 I中反应前后B的质量差,再通过相应计算,就可测定Na2CO3的纯度,小组内同学通过讨论认为不可以,其理由可能是 _______________________;
(二)小钱同学在大家讨论的基础上,设计了装置II。请分析:装置II中A的作用_____________;若无装置C,对测定结果造成的影响是_____________(填“偏大”、“偏小”或“无影响”);E装置的作用是_______________________________。
【实验结论】称取10g样品于圆底烧瓶中,实验结束后,测得装置D增重2.2g,请你计算出样品中Na2CO3质量分数为____________。(写出计算过程)
【反思评价】(一)实验室中的氢氧化钠应密封保存,除了因为空气中有二氧化碳,还因为___________。
(二)若将上述5g氢氧化钠固体全部溶解在45g水中,得到的溶液中氢氧化钠质量分数______10%(填“大于”、“小于”或“等于”)。
【题目】某实验小组的同学用氢氧化钠溶液和稀硫酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加稀硫酸一会儿后,发现忘记了滴加指示剂。此时,他们停止滴加稀硫酸,并对烧杯内溶液中溶质的成分进行探究。Ⅰ.写出该中和反应的化学方程式_________。
Ⅱ.探究烧杯内溶液中溶质的成分:
【提出问题】该烧杯内溶液中溶质是什么?
【进行猜想】
猜想一:可能是Na2SO4与NaOH;猜想二:可能只是Na2SO4;猜想三:可能是_________。
【查阅资料】Na2SO4溶液呈中性。
【实验探究】
实验步骤 | 实验现象 | 实验结论 |
(1)取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡 | _________ | 猜想一不正确 |
(2)取少量烧杯内溶液于另一支试管中,滴加碳酸钠溶液 | _________ | 猜想二不正确,猜想三正确 |
【反思与拓展】
(1)探究猜想三成立,除以上方案外,下列哪些物质也能完成该实验?_________(填序号)
A.pH试纸 B.铜 C.氧化铜 D.氢氧化铜
(2)甲、乙两位同学准备测定反应后溶液中H2SO4的质量分数。
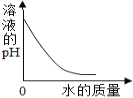
①甲同学取50g该溶液于烧杯中,逐滴滴入溶质质量分数为10%的NaOH溶液,反应过程中溶液的pH变化如右图所示,求溶液中H2SO4的质量分数_________。(写出计算过程)
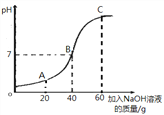
②试写出A点溶液中的溶质_________。
③乙同学改用BaCl2溶液代替NaOH溶液,根据生成沉淀的质量来确定溶液中H2SO4的质量分数,你认为结果将_______(填“偏大”“偏小”或“无影响”)。