��Ŀ����
ijУѧ����̼������Һ����ϡ���ᡢʳ��ˮ�ͳ���ʯ��ˮ����������������ʵ��̽����
������ʵ�顿
| �������� | ʵ������ | ʵ����� |
| �ֱ���A��B��C��֧�Թ�ȡ����Ȼ�����������̼������Һ | A�� B�� C�� | A�е�������ʳ��ˮ B�е�������ϡ���� C�е������dz���ʯ��ˮ |
д��C�з�Ӧ�Ļ�ѧ����ʽ ��
���������⡿��δ���������Һ���ܼ��ٶԻ�������Ⱦ��
��˼���������Ӧ�ȶԷ�Һ�е����ʳɷֽ���̽�������ƶ�������
��ʵ����̽����
��1����ͬѧ�����з�Һ�����ҽྻ�ձ��У����ú�õ��ϲ���Һ��
��2��ȡ������Һ�����������Ȼ�����Һ�����ԣ������ְ�ɫ���������� ������Һ�ٵμӼ�����ɫ��̪��Һ����Һ��Ϊ��ɫ���ɴ�����˵����ͬѧ�����ϲ���Һ��һ������ �� ��һ��û�� �����������ƣ���
��������Ӧ�á�����̽���Ľ�����ʾ���ǣ�����������Һ����ȷ������ ��
[��������]
Ca��OH��2+Na2CO3=CaCO3��+2NaOH�������� ʵ������ ʵ����� �ֱ���A��B��C��֧�Թ�ȡ����Ȼ�����������̼������Һ A�� ����������
B�� �����ݲ���
C�� �г�������A�е�������ʳ��ˮ
B�е�������ϡ����
C�е������dz���ʯ��ˮ
[ʵ����̽��]̼���ƣ��������ƣ��������ƣ�
[������Ӧ��] ʹ������к͵ķ���ʹ��Һ������
��������������������飺A����ʳ��ˮ����̼�������Ȼ��Ʋ���Ӧ����ʵ��������������B����ϡ���ᣬ��������̼���Ʒ�Ӧ���ɶ�����̼���壬�����ݲ�����C��������ʯ��ˮ��̼���������������Ʒ�Ӧ����̼��Ƴ�������Һ�����ǣ���C�з�������̼�������������Ƶķ�Ӧ�����������ʷ�Ӧ����̼��Ƴ������������ƣ����
Ca��OH��2+Na2CO3=CaCO3��+2NaOH���������� ʵ������ ʵ����� �ֱ���A��B��C��֧�Թ�ȡ����Ȼ�����������̼������Һ A�� ����������
B�� �����ݲ���
C�� �г�������A�е�������ʳ��ˮ
B�е�������ϡ����
C�е������dz���ʯ��ˮ
ʵ����̽������2���Ȼ�������̼���Ʒ�Ӧ���ɰ�ɫ��������Һ��ʹ��̪��죬˵����Һ�ʼ��ԣ���Һ��һ�������������ƣ�̼���������������Ʒ�Ӧ����һ�����Ậ���������ƣ����̼���ƣ��������ƣ��������ƣ�
������Ӧ�ã�������ҺҪ����Һ�е���������ʳ��������������кͷ�Ӧ��ԭ�������ʹ������к͵ķ���ʹ��Һ�����ԣ�
���㣺�ᡢ��εļ�����д��ѧ����ʽ�����ֱ���ʽ�����뷽��ʽ��
���������⿼���˳������ʵļ����Լ���Һ�Ĵ�������ɴ��⣬�����������ʵ����ʽ���

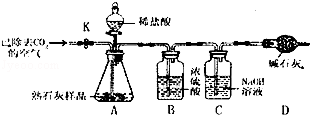
��ѧС��ͬѧ�ڼ��ȶ���������Ʒʱ�����������ݲ�������ͼһ��ʾ�����������Ƕ�����쳣���������̽����
��1��������ɷֵ�̽�������ȶ���������Ʒ����ȼ�ŵ�ľ�������Թܿڣ�ľ��Ϩ�𡣽�����ͨ������ʯ��ˮ������ʯ��ˮ����ǣ������������� ��
��2����������Դ��̽����
��ͬѧ��Ϊ���������������Թ��еĿ������������ʵ��֤���ü��費����
| ʵ�鲽�輰���� | ���� |
| ���ȿյ��Թܣ���һ�˵ij���ʯ��ˮû�б���� | ���� ������������������� |
��ͬѧ��Ϊ������������Ʒ�п��ܻ���̿�ۣ�̿�۷�����Ӧ�����˸����塣���������ͼ����ʾ��ʵ������о�������Bװ�õ������Ǽ���A�з�Ӧ�Ƿ���ȫ��B�е��Լ��� ��ʵ���й۲쵽D������ʯ��ˮ����ǡ������õ�����������������������ʵ���е��κη�Ӧ�����ظ�����ʵ�飬����D�������ʯ��ˮҲ����ǡ�ͨ����ͬѧ��ʵ��֤�������������л���̿�ۣ�̿���� ��Ӧ�������������塣
С����ʵ������֤���ữѧ����ʱ����̼������Һ����װ��ϡ������ձ��п��������ݲ�����Ϊ�˽��������ʼ�ķ�Ӧ������������ӷ�Ӧ����Һ�����ʵ�������ֽ���̽����
��1��С���Է�Ӧ����Һ������������ֲ��룬�����ٲ���һ�ֲ���
����1������ΪNaCl��Na2CO3
����2������ΪNaCl��HCl
����3������Ϊ_________
��2���Ƚ����ֲ��룬˵�����������3�����ɣ�_________
��3��С�����������ͬ��ʵ�鷽���������ַ�����֤�˲���2��������Ҫ����д�±���
| | ʵ����� | ʵ������ | ʵ����� |
| ����һ | ȡ������Ӧ����Һ������_________ | _________ | ����2���� |
| ������ | ȡ������Ӧ����Һ��������������Һ | _________ | ����2���� |
����Ϊ�������Ƿ���ȷ_________ ��˵�����ɣ�_________ ��
С���ҵ��·�װ�ޣ��߹�ʦ����ʯ�ҽ�����Ҫ�ɷ����������ƣ�Ĩǽ���չ�ʱ�߹�ʦ����δ�����ʯ�ҽ���ɳ�����ϣ��Ա��ڶ������ã���������Ŀ���Ƿ�ֹʯ�ҽ�����ʶ�ʧЧ��
��1�����������ѧ֪ʶд��ʯ�ҽ����ʵĻ�ѧ����ʽ�� ����
��2��С����ͨ��ʵ����֤ʯ�ҽ��ı���������������С���������ʵ�飮
| ʵ�鲽�� | ʵ������ | ʵ����� | |
| ȡ������һ����ˮ����ܽ���� | ȡ�����������Թ��У����������� �� | �� �� | ��ʯ�ҽ����ֱ��� |
| ȡ������Һ���Թ��У�������ɫ��̪��Һ | �� �� | ||
��3���ɴ�С�����뵽ʵ�������һЩҩƷ�����ܷⱣ�森ʵ�����б����ܷⱣ���ҩƷ�ɷ�Ϊ���¼��ࣺ
��ҩƷ��������еijɷַ�����Ӧ��������ʯ��ˮ��
��ҩƷ���лӷ��ԣ����� ����
���� ������Ũ���ᣮ
��ѧС��ͬѧ̽������Ļ�ѧ���ʡ���������벢������в���ʵ�����ݣ�
| ʵ����� | ʵ������ | ʵ����� |
 | �ٺ��Թܣ������ܽ⣬�������ݣ����ȣ� �ں��Թܣ��� ���� | a��������ԣ� þ�� ��ͭ������������� b���漰���Ļ�ѧ����ʽ�� ���� |
��2�� | �ۺ��Թܣ���ɫ��ĩ���ܽ⣬�������ݣ���Һ����ɫ�� �ܺ��Թܣ���ɫ��ĩ���ܽ⣬�������ݣ���Һ����ɫ�� | Cu2��OH��2CO3+2H2SO4�T2CuSO4+3H2O+CO2�� Cu2��OH��2CO3+4HCl�T2CuCl2+3H2O+CO2�� |
���������⡿��ʽ̼��ͭ��ϡ���ᷴӦ�γɵ�CuSO4��Һ����ɫ���������ᷴӦ�γɵ�CuCl2��Һ����ɫ��
��������⡿ͬ��������Cu2+��Ϊʲô�ۺ��Թ��е�CuSO4��Һ����ɫ�����ܺ��Թ��е�CuCl2��Һ����ɫ��
����������衿����һ������Һ��Cu2+����ɫ����SO42+��Cu2+��ɫ��Ӱ�죬��Cl����Cu2+��ɫ��Ӱ�죻
�����������Һ��Cu2+����ɫ������ ����
����������
��ʵ����֤��ͬѧ�����������ֲ�ͬ����������֤����һ�����㲹ȫʵ�������Լ���
����һ��ȡ�����ۺ��Թ��е���Һ����һ֧�Թ��У������м����� �����۲쵽Ԥ��ʵ��������һ��ȷ��
��������ȡ�����ܺ��Թ��е�CuCl2��Һ����һ֧�Թ��У������м����� �����۲쵽Ԥ��ʵ��������һ��ȷ��
�������뷴˼��ͬѧ����ʵ��̽���Ĺ����У���ᵽ����Һ��ɫ�����ӣ����֪ʶ���д���һ��ѧϰ��
KOH��Һ�к���H2O��K+��OH-����ʹ��ɫ��̪��Һ��ɺ�ɫ��ij��ѧ��ȤС����̽��KOH��Һʹ��ɫ��̪��Һ��ɺ�ɫ��ԭ��
��������⡿KOH��Һ�е�ʲô�ɷ�ʹ��ɫ��̪��Һ��죿
�����롿����1��KOH��Һ�е�H2Oʹ��ɫ��̪��Һ��졣
����2��KOH��Һ�е�K+ʹ��ɫ��̪��Һ��졣
����3��KOH��Һ�е�_______________���ѧʽ��ʹ��ɫ��̪��Һ��졣
��ʵ��̽����
| ʵ����� |
| ���� | ||
| �����Թ�ȡ��������ˮ������1-2����ɫ��̪��Һ | �Թ�����Һ����ɫ | ����1������ | ||
| �����Թ�ȡ����KCl��Һ������1-2����ɫ��̪��Һ |  | ����2������ | ||
| ��________________������1-2����ɫ��̪��Һ | �Թ�����Һ��� |  |
�����۷�˼����ͬѧ��Ϊ����ٲ���Ҫʵ����֤�Ϳ����ų�������Ϊ��ͬѧ������______��
����չ������Ba(OH)2��Һ�е��뼸����ɫ��̪��Һ���۲쵽��������________________��
��KOH����Ӧ__________���档