题目内容
铁缓慢氧化生成Fe2O3,发生反应的化学方程式为4Fe+ 3O2 =2Fe2O3,计算生成80g Fe2O3需要铁的质量(写出计算过程)。
解:设需要铁的质量为x
4Fe + 3O2 == 2Fe2O3
4×56 2×160
x 80g
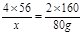 x=56g
x=56g
答:需要铁的质量为56g。
4Fe + 3O2 == 2Fe2O3
4×56 2×160
x 80g
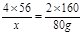 x=56g
x=56g答:需要铁的质量为56g。
设需要铁的质量为x
4Fe+3O2═2Fe2O3
4×56 2×160
x 80g
=
x=56g
答:需要铁的质量为56g.
4Fe+3O2═2Fe2O3
4×56 2×160
x 80g
| 4×56 |
| x |
| 2×160 |
| 80g |
x=56g
答:需要铁的质量为56g.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
 2NaOH+H2
2NaOH+H2 +Cl2
+Cl2

