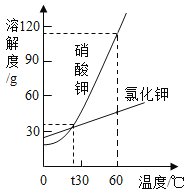
题目内容
“宏观辨识与微观探析”是化学学科的核心素养之一。对下列事实或做法的解释正确的是
A.铁质水龙头表面镀铬可防锈——改变了金属的内部结构
B.伍德合金可作为保险丝——合金的熔点比其组成金属高
C.用明矾净水——明矾可降低水中钙、镁离子的含量
D.氧气能被液化贮存于钢瓶——分子间有间隔且间隔能改变
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案金属及其化合物在生产生活中有广泛的应用。
(一)金属的应用和防护
(1)飞机的燃料是航空煤油,它主要是由____炼制的(填“石油”或“煤”)。
(2)铁生锈需要同时接触O2和____,请提出生活中铁制品防锈的一种方法____。
(3)特种钢中的Mn可以由MnO2和Al粉混合在高温下通过置换反应制得,该化学方程式为____。
(4)Mg(OH)2受热分解生成MgO,Mg(OH)2用作阻燃剂,其原理是____(填字母)。
A 分解吸热,降低环境温度 B MgO覆盖燃烧物,隔绝氧气
(二)制备还原性铁粉
实验室利用废铁屑(含少量Fe2O3)为原料制备还原性铁粉的流程如下:
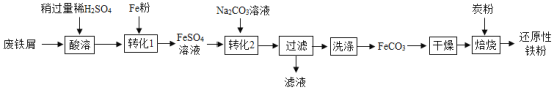
(1)Fe粉可使“酸溶”产生的Fe2(SO4)3转化为FeSO4,该反应的化学方程式为____。
(2)检验FeCO3已洗净的方法:取最后一次洗涤后的滤液,先加入一定量稀盐酸,除去CO32-,再滴加____溶液,无明显现象。
(3)“干燥”发生转化:FeCO3 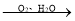 FeOOH+CO2,该转化的化学方程式为____。
FeOOH+CO2,该转化的化学方程式为____。
(4)“焙烧”前,应将炭粉与“干燥”所得固体均匀混合,目的是____。
(三)测定还原性铁粉的组成
还原性铁粉中含有少量FexCy,小组同学在老师的指导下进行以下实验。
资料:① Fe,FexCy在加热时与O2反应能生成Fe2O3和CO2。
②FexCy不与酸反应。
实验1:取30.48g样品,加入足量稀H2SO4,充分反应后生成1.00gH2。
实验2:另取30.48g样品,按下图进行实验。
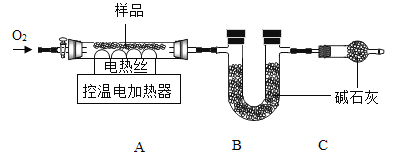
表:装置A和B的质量变化
装置 | A | B |
反应前 | 400.00g | 400.00g |
反应后 | mg | 400.88g |
实验后A中固体全部变为红棕色,装置A、B的质量变化如上表。
(1)装配好装置后,实验前先要____。
(2)装置C的作用是____。
(3)FexCy中,x:y=____。表中m的值是____g。
(实验反思):若用空气(除去CO2)的替代O2进行实验,测得x:y的值偏大,可能的原因是____。