题目内容
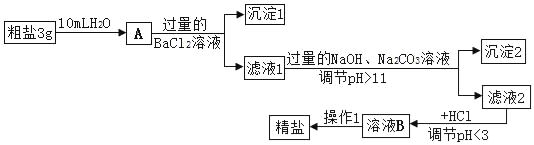
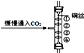
【题目】水煤气的主要成分是CO和H2(少量CO2和水蒸气),某同学通过下列实验,验证水煤气的主要成分,请根据下图所示装置,回答有关问题.
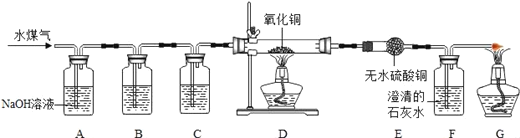
(1)A装置中反应的化学方程式是___;
(2)B装置内盛放的物质是___,其作用是___;
(3)C装置内盛放的物质是___;
(4)D装置内的现象是___;
(5)若E装置与F装置位置颠倒,其后果是___.
【答案】CO2+2NaOH═Na2CO3+H2O; 澄清石灰水 检验水煤气中的CO2是否已除尽 浓硫酸 黑色粉末变成红色 不能证明水煤气中H2的存在
【解析】
(1)A中氢氧化钠溶液只可与水煤气中的二氧化碳反应,生成碳酸钠和水;
(2)B装置的作用应该是检验二氧化碳是否被除尽,所以应盛放澄清石灰水;
(3)然后再把剩余的水分除去,所以C装置中要盛放吸收水分很强的浓硫酸;
(4)剩余的CO和H2可以还原D装置中的黑色氧化铜,生成红色的铜,所以D装置的现象是黑色粉末变成红色.
(5)E装置的作用是检验是否有水分,即看有无H2存在;F装置中的澄清石灰水用于检验二氧化碳的存在,如果二者颠倒,F装置中的水分进入E装置,也会使E中的无水硫酸铜变色,就不能证明水煤气中H2的存在.

练习册系列答案
 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目