题目内容
【题目】向一定质量的CaCl2和HC1的混合溶液中逐滴加入溶质质量分数为10.6%的Na2CO3溶液,实验过程中加入Na2CO3溶液的质量与产生沉淀或气体的质量关系如图所示。下列说法错误的是
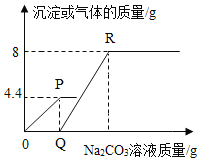
A.P点时的溶液只含一种溶质
B.R点时的溶液只含一种溶质
C.0至P过程中溶液的pH变大
D.Q至R段表示生成沉淀的过程
【答案】A
【解析】
向一定质量的CaCl2和HC1的混合溶液中逐滴加入溶质质量分数为10.6%的Na2CO3溶液,碳酸钠先于稀盐酸反应,再与氯化钙反应。
A.在P点时,溶液中的HCl恰好被消耗完,溶液中的溶质是氯化钠和氯化钙,故A错误;
B.R点表示碳酸钠和氯化钙恰好完全反应,溶液中的溶质只有氯化钠,故B正确;
C.在刚开始时,溶液中含有盐酸,溶液呈酸性,pH<7,到P点时碳酸钠和HCl恰好完全反应,溶液pH=7,0至P过程中溶液的pH变大,故C正确;
D.Q至R段表示碳酸钠和氯化钙反应的过程,即是碳酸钙的生成过程,故D正确。
故选:A。

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】某校研究性学习小组在探究中和反应时,先取10mL稀氢氧化钠溶液,滴加两滴酚酞溶液,溶液显红色。然后逐滴滴入稀盐酸并搅拌,至红色恰好变成无色。小组同学对该实验进行了如下探究:
(1)请写出氢氧化钠溶液和盐酸反应的化学方程式_____。
(2)深入探究:上述反应中, 究竟是稀盐酸中哪种粒子参加反应?
[提出假设]假设1: H2O 参加反应;
假设2: H+ 参加反应;
假设3:_____参加反应
[设计实验]
学习小组的同学们取10mL稀氢氧化钠溶液,滴加两滴酚酞溶液,将变红后的溶液分成四等分后分别置于四支试管中,进行如下实验:
实验编号 | 实验步骤 | 实验现象 | 结论 |
① | 向其中一支试管滴加1mL蒸馏水 | 溶液不变色 | 假设1不成立 |
② | 向其中一支试管滴加1mL稀硫酸溶液 | 溶液变成无色 | 假设2_____(填“成立”或“不成立”) |
向其中一支试管滴加1mL硫酸钠溶液 | 溶液不变色 | ||
③ | 向其中一支试管滴加1mL_____溶液 | 溶液不变色 | 假设3_____(填“成立”或“不成立”) |
[实验反思]
经过讨论,小组同学一致认为假设1不需要经过实验就可以推导出其不成立,理由是_____。
[实验拓展]小琳同学查阅资料后发现,对于没有明显现象的化学变化,可以通过验证反应物消失、新物质生成、监测温度、pH变化等来“造出现象”,使反应现象明显,从而获得正确的认识。请再设计出一种不同的实验方案证明氢氧化钠溶液与稀盐酸确实发生了化学反应:_____。
[实验延伸]小芳同学实验后与同组其他同学认真讨论,然后认为直接向含有酚酞溶液的氢氧化钠溶液中滴加稀盐酸,观察到红色褪去,并不能证明就是加入的稀盐酸与氢氧化钠发生反应,你认为她的观点是否合理?并说明理由。_____。
【题目】为测定某碳酸钠样品的纯度,现取12g碳酸钠样品溶于水中,将三份相同的氯化钙溶液,依次加入到盛有碳酸钠溶液的烧杯中,生成沉淀的质量总和(包含前一次的沉淀量)如下表所示。(化学方程式:Na2CO3+CaCl2=CaCO3↓+2NaCl,杂质不参与该反应)
加入氯化钙溶液次数 | 第一次 | 第二次 | 第三次 |
生成沉淀的总质量/g | 4.5 | m | 10 |
(1)表格中m的数值是_____。
(2)碳酸钠中钠元素的质量分数为_____(只列数字算式,不计算结果)。
(3)求此样品中碳酸钠的质量分数_____(写出计算过程结果,精确到1%)。