题目内容
【题目】下图所示为实验室中常见气体制备、净化、干燥、收集和进行实验探究的部分仪器(组装实验装置时,可重复选择仪器),某化学小组的同学欲利用其进行下列各化学实验。
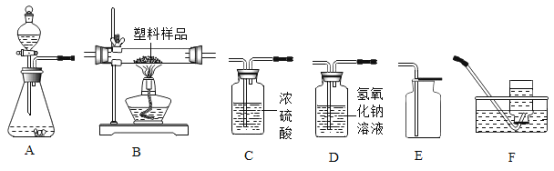
(1)以过氧化氢溶液和二氧化锰为原料,在实验室中制备并收集干燥的氧气,按照要求设计实验装置,连接仪器,并检验装置的气密性。
①反应发生时,可观察到装置A中锥形瓶内明显的现象是_____
②所选装置的连接顺序为_______(从左至右填写装置序号字母)。
③制取氧气所发生反应的化学方程式为_____
④下列有关叙述中,不正确的是_______(填写序号)
A 氧气能支持燃烧,可以做燃料
B 氧气是一种化学性质比较活泼的气体
C 二氧化锰加快了过氧化氢制取氧气的速率
D 铁丝在纯氧中剧烈燃烧后生成白色固体物质
(2)塑料方便袋的使用会造成“白色污染”。某化学研究小组的同学欲对某种塑料袋(资料显示该塑料只含C、H两种元素)的组成进行分析探究,他们所选装置按“氧气(含少量水蒸气)→C1→B→C2→D→碱石灰干燥管”的顺序连接(实验前检验装置的气密性,假设所发生的化学反应都完全充分进行),使该塑料试样在纯氧中燃烧,观察实验现象,分析有关数据,推算元素含量。
①仪器C1的作用是_____
②仪器D中发生反应的化学方程式是_____
③若仪器B的玻璃管中放入的塑料试样质量为Wg,塑料试样充分燃烧后,如果仪器C2增重ag,则Wg该塑料试样中含氢元素的质量为_____g(计算结果可为分数形式)。
④若装置中没有连接仪器C1,将使该塑料试样中氢元素的质量测算结果______(填“偏小“偏大“无影响”之一)。
【答案】有大量的气泡产生 ACE 2H2O2![]() 2H2O+ O2↑ AD 吸收氧气中水蒸气(干燥氧气) 2NaOH + CO2 = Na2CO3 + H2O
2H2O+ O2↑ AD 吸收氧气中水蒸气(干燥氧气) 2NaOH + CO2 = Na2CO3 + H2O ![]() 偏大
偏大
【解析】
(1)①过氧化氢在二氧化锰催化作用下反应生成水和氧气,反应发生时,可观察到装置A中锥形瓶内明显的现象是有大量的气泡产生;
②以过氧化氢溶液和二氧化锰为原料制氧气,该反应的反应物是固体与液体,不需要加热,可选用的发生装置为A,制得的氧气中含有水蒸气,浓硫酸具有吸水性,可除去水蒸气,排空气法收集的氧气比排水法收集的氧气干燥,氧气的密度大于空气,可用向上排空气法收集。所选装置的连接顺序为ACE;
③制取氧气所发生反应的化学方程式为:2H2O2![]() 2H2O+ O2↑ ;
2H2O+ O2↑ ;
④A 氧气能支持燃烧,没有可燃性,不可以做燃料,故A错误;
B 氧气能与许多物质发生化学反应,是一种化学性质比较活泼的气体,故B正确;
C 二氧化锰加快了过氧化氢制取氧气的速率,故C正确;
D 铁丝在纯氧中剧烈燃烧后生成黑色固体物质,不是白色固体物质,故D错误。故选AD;
(2)①浓硫酸具有吸水性。仪器C1的作用是吸收氧气中水蒸气(干燥氧气);
②氢氧化钠与二氧化碳反应生在成碳酸钠和水,仪器D中发生反应的化学方程式是2NaOH + CO2 = Na2CO3 + H2O;
③若仪器B的玻璃管中放入的塑料试样质量为Wg,塑料试样充分燃烧后,仪器C2中的浓硫酸能吸收B装置中反应生成的水,根据质量守恒定律可知,水中氢元素质量等于塑料试样中含氢元素的质量,如果仪器C2增重ag,则Wg该塑料试样中含氢元素的质量为![]() ;
;
④若不连接装置C1,会导致装置C2增加质量偏大,即水多了,由此计算出的氢元素质量偏大。