题目内容
【题目】某粗盐中含有杂质氯化镁、氯化钙、硫酸铵、泥沙,要得到纯净的氯化钠,某同学涉及如下实验:
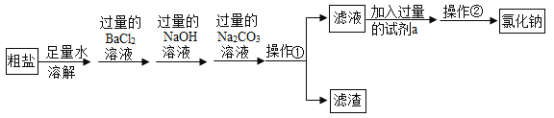
(1)写出加入过量碳酸钠的化学方程式_________。(任写一个)
(2)若加入的试剂a为稀硫酸,则会引发的后果是什么_________?
【答案】BaCl2+N a2CO3=BaCO3↓+2NaCl或CaCl2+Na2CO3=CaCO3↓+2NaCl; 带入新的杂质硫酸钠
【解析】
碳酸钠和氯化钙反应生成白色沉淀碳酸钙和氯化钠,和氯化钡反应生成白色沉淀碳酸钡和氯化钠;稀硫酸和氢氧化纳反应生成硫酸钠和水,和碳酸钠反应生成硫酸钠、水和二氧化碳。
(1)加入过量碳酸钠,碳酸钠和氯化钙反应生成白色沉淀碳酸钙和氯化钠,和过量的氯化钡反应生成白色沉淀碳酸钡和氯化钠,反应的化学方程式:BaCl2+N a2CO3=BaCO3↓+2NaCl,CaCl2+Na2CO3=CaCO3↓+2NaCl;
(2)若加入的试剂a为稀硫酸,稀硫酸和过量的氢氧化钠、碳酸钠反应生成硫酸钠,则会引发的后果是带入新的杂质硫酸钠。

【题目】实验小组以鸡蛋壳(主要成分碳酸钙,在水中能溶解出微量的 Ca2+,其他成分 对实验影响忽略不计)为牙齿的替代物,模拟含氟牙膏保护牙齿的化学原理。
(查阅资料)① 含氟牙膏保护牙齿的原因:含氟牙膏中的氟化钠(NaF)能与牙齿表面溶解的 微量 Ca2+反应,生成更难溶于酸的物质。
② 常温下,酚酞溶液遇 pH<8.2 的碱性溶液不变色。
(进行实验)实验小组用 2 种不同的方法进行实验。
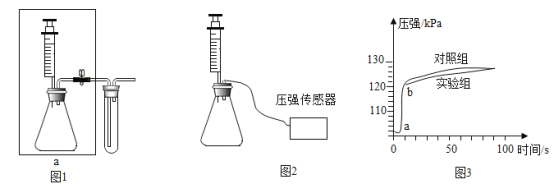
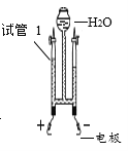
实验一:如图 1 连接仪器,进行实验(注射器中药品全部缓慢注入锥形瓶中)。
实验组 | 对照组 | |
锥形瓶中的物质 | 0.5g用含氟牙青处理过的鸡蛋壳 | 0.5g未用含氟牙青处理过的鸡蛋壳 |
注射器中的物质 | 20mL3.5%的盐酸 | _____ |
试管中的物质 | 滴有酚酞的氢氧化钠稀溶液 | 滴有酚酞的氢氧化钠稀溶液 |
试管中溶液褪色时间(s) | t1 | t2 |
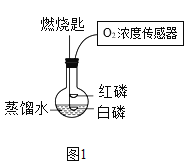
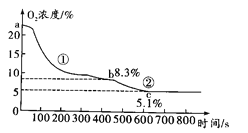
实验二:如图 2 连接仪器,锥形瓶和注射器中的物质均与实验一相同。实验过程,通过压强 传感器测得压强随时间的变化如图 3 所示。
(解释与结论)
(1)装入药品前,检查装置 a 的气密性:用止水夹夹住右侧橡皮管,_____, 说明装置气密性良好。
(2)实验二能证明含氟牙膏对鸡蛋壳有保护作用,其理由是_____。 由此推断出实验一中,t1_____t2(填“>”、“<”或“=”)。
(3)图 3 中“a-b”段压强增大的主要原因是_____。
(反思与评价)
(4)根据本实验模拟的含氟牙膏保护牙齿的化学原理,你认为碳酸钙_____(填“能” 或“不能”)用于制作含氟牙膏的摩擦剂,理由是_____。