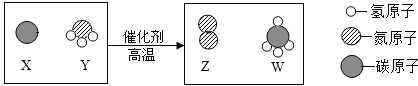
题目内容
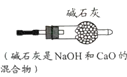
【题目】进行如下微型实验,研究物质的性质。

(1)烧杯 B 中发生的化学反应方程式是____________。
(2)能证明 C 中发生反应的现象是____________。
(3)有一只烧杯中的物质不与稀盐酸反应,原因是____________。
【答案】![]() 溶液由红色变为无色 A中铜的金属活动性排在氢的后面,不与盐酸反应生成氢气
溶液由红色变为无色 A中铜的金属活动性排在氢的后面,不与盐酸反应生成氢气
【解析】
镁和稀盐酸生成氯化镁和氢气,稀盐酸和氢氧化钙生成氯化钙和水,碳酸氢钠和盐酸反应生成氯化钠、水二氧化碳,氧化铁和盐酸反应生成氯化铁和水。
(1)烧杯B中发生的反应是镁和稀盐酸生成氯化镁和氢气,反应的化学反应方程式是![]() 。
。
(2)滴有酚酞的澄清石灰水溶液是红色的,稀盐酸和氢氧化钙生成氯化钙和水,溶液由红色变为无色,故能证明 C 中发生反应的现象是溶液由红色变为无色。
(3)A烧杯中,铜的金属活动性性排在氢的后面,不与盐酸反应生成氢气,故有一只烧杯中的物质不与稀盐酸反应,原因是铜的金属活动性排在氢的后面,不与盐酸反应生成氢气。

 阅读快车系列答案
阅读快车系列答案【题目】过氧化钠是化学中常见的一种药品,它是浅黄白色颗粒粉末.在空气中吸收水分和二氧化碳。易溶于水,与水中能发生反应生成氢氧化钠和过氧化氢,方程式:Na2O2+2H2O=2NaOH+H2O2,过氧化氢又能分解放出氧气。
(1)区分水和过氧化氢的实验方法是:___________________________,发生的反应方程式是:__________________________.
(2)某同学为了证明过氧化钠加入水中生成了氢氧化钠,在生成的溶液中滴加了几滴无色酚酞试液,观察到的现象是溶液先变红后褪为无色,请你对此现象进行探究.
提出问题:什么导致溶液先变红再褪色?
猜想与假设:
猜想1:甲同学“可能是无色酚酞溶液变质导致溶液褪色”;
猜想2:乙同学“可能是生成的过氧化氢使溶液褪色”.
实验与结论:
a:甲同学提出的猜想,立即遭到其他同学的反对,因为______________________________;
b:为了验证自己的猜想,乙同学设计了以下方案并实验验证:
实验步骤 | 实验现象 | 实验结论 |
取少量稀氢氧化钠溶液于试管中,滴加1﹣2滴酚酞试液,变红后,___________观察现象 | 溶液依然为红色 | ____________________ |
讨论交流:你还能提出不同的猜想吗?如果还能提出新的合理的假设和方案你将获得奖励分4分.
猜想3:_____________
方案3:
实验步骤 | 实验现象 | 实验结论 |
_________________ | _______________ | ______________ |