题目内容
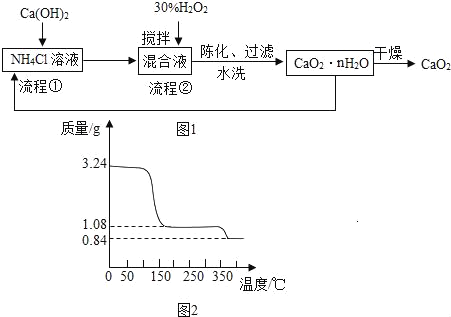
【题目】同学们为了测定该纯碱样品中碳酸钠的质量分数(已知样品中只含氯化钠一种杂质),设计了如图实验:
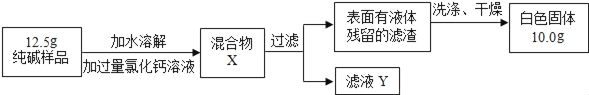
(1)判断滤渣是否洗涤干净,可以采取向最后的洗出液中滴加___,然后观察现象判断。
A 氯化钡溶液 B 硝酸银溶液 C 碳酸钠溶液 D 稀盐酸
(2)根据实验数据,得出样品中碳酸钠的质量分数是___。
(3)若过滤所得滤液Y的质量为136克(忽略过滤过程中滤渣表面的氯化钠残留),则该滤液中氯化钠的质量分数为___。
【答案】C 84.8% 10%
【解析】
(1)由氯化钙能与碳酸钠反应生成了碳酸钙沉淀,所以判断滤渣是否洗涤干净,可以采取向最后的洗出液中滴加碳酸钠溶液,然后观察现象判断。
(2)设碳酸钠的质量分数是x,生成的氯化钠的质量为y
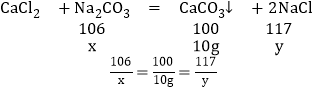
解得:x=10.6g y=11.7g
样品中碳酸钠的质量分数是:![]() ×100%=84.8%
×100%=84.8%
(3)则该滤液中氯化钠的质量分数为:![]() 。
。

【题目】(1)如图是实验室制取气体的一些装置,据图回答:
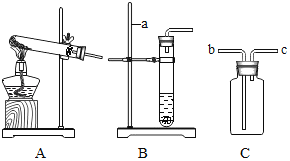
①如图仪器a的名称是_____。
②用高锰酸钾制取氧气的化学方程式是_____。若用C装置收集氧气,验满时,应将带火星的木条放在_____(填“b”或“c”)端导管口,若木条复燃,说明氧气已满。
(2)某校化学兴趣小组在学完碱的化学性质后,做了澄清石灰水和稀盐酸反应的实验,并将废液倒入一洁净的废液缸中,进行了如下探究:
探究Ⅰ:甲同学在做实验时没有观察到明显现象,于是对澄清石灰水和稀盐酸能否发生反应表示怀疑,乙同学认为,甲同学实验时应先向澄淸石灰水中滴几滴酚酞试液,再滴加适量的稀盐酸,当观察到_____时,就可以说明两种物质能发生反应。
探究Ⅱ:废液中溶质的成分是什么?
(做出猜想)
猜想一:CaCl2
猜想二:CaCl2、HCl
猜想三:CaCl2、HCl、Ca(OH)2
你的猜想:_____
丙同学认为猜想三是错误的,理由是_____(用化学方程式解释)。
(实验设计)
设计者 | 实验操作 | 实验现象 | 实验结论 |
丁同学 | 取少量废液于一支试管中,向其中加入足量的碳酸钠溶液 | 有白色沉淀生成 | 猜想一正确 |
戊同学 | 取几粒锌粒于一支试管中,向其中加入少量废液 | _____ | 猜想二正确 |
(评价与反思)请判断以上设计的两个方案中,_____同学的方案合理,请分析另一个方案不合理的理由:_____。
(表达与交流)若实验证明猜想二是正确的,你认为该废液来经处理直接倒入下水道,可能造成的危害是_____(填一点)。