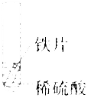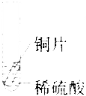题目内容
【题目】(4分)请根据下图所示的实验过程和提供的数据计算:

(1)生成氢气的质量。
(2)合金中铜的质量分数。
(3)所加稀硫酸的质量。
【答案】(1)0.2g(2)35% (3)93.7 g
【解析】
试题分析:根据硫酸锌质量,利用化学方程式进行计算,得出氢气和锌的质量;再利用质量守恒定律进行计算得出稀硫酸质量。
解:生成ZnSO4的质量为100g×16.1%=16.1g
设:生成氢气的质量为x,消耗锌的质量为y。
Zn+H2SO4=ZnSO4+H2↑
65 161 2
y 16.1g x
2 :x=161:16.1g
x= 0.2g
65 :y =161:16.1g
y= 6.5 g
(10 g -6.5 g)/10 g ×100%=35%
所加稀硫酸的质量:100 g+0.2 g-6.5 g=93.7 g
答:略。

练习册系列答案
相关题目